
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用铬,通常采用如下流程处理:
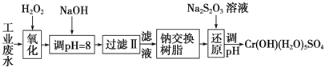
注:部分阳离子常温下沉淀时的pH见下表
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀pH | 1.4 | 7 | 9.1 | 3.4 | 4.3 |
完全沉淀pH | 3.7 | 9.6 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:________________;其中Cr3+被氧化为Cr2O72-,该反应的离子方程式为:____________,氧化Cr3+的目的是__________。
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是_____。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:_________________。
【答案】 氧化为Fe3+之后,可以通过调节溶液pH除去 2Cr3++3H2O2+H2O=Cr2O72-+8H+ 防止调节溶液pH时将Cr元素沉淀除去 AB CD 4∶3
【解析】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,据此解答。
(1)根据以上分析可知氧化Fe2+的目的是将亚铁离子氧化为Fe3+之后,可以通过调节溶液pH除去:其中Cr3+被氧化为Cr2O72-,根据电子得失守恒可知该反应的离子方程式为2Cr3++3H2O2+H2O=Cr2O72-+8H+;根据表中数据可知氧化Cr3+的目的是防止调节溶液pH时将Cr元素沉淀除去。
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去,答案选AB;通过钠离子交换树脂,除去Ca2+和Mg2+,答案选CD;
(3)还原过程中Cr元素化合价从+6价降低到+3价,1molCr2O72-得到6mol电子。S元素化合价从+2价升高到+6价,则1molNa2S2O3失去8mol电子,所以根据电子得失守恒可知氧化剂和还原剂的物质的量之比为8∶6=4∶3。


科目:高中化学 来源: 题型:
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO32- |
B |
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的示意图所示,下列说法正确的是( ) 
A.物质酸性的比较:CH3COOH>HSCN>H2CO3
B.反应结束后所得两溶液中,c(CH3COO﹣)>c(SCN﹣)
C.上述三种溶液中由水电离的c(OH﹣)大小:NaHCO3>CH3COOH>HSCN
D.CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO﹣)+c(CH3COOH)=0.10molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的一种新型可充放电AGDIB电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1+Al。放电过程如图,下列说法正确的是( )

A. B为负极,放电时铝失电子
B. 电解液可以用常规锂盐和水代替
C. 放电时A电极反应式为CxPF6+e-=Cx+PF6-
D. 放电时,若转移1mol电子,石墨电极上可增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由阿伏伽德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量
B.1摩尔水蒸气的质量
C.1摩尔水的体积
D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测血钙的含量时,进行如下实验: ①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉徙用稀硫酸处理得H2C2O4溶液.
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+ .
③终点时用去20mL 1.0×l0﹣4 mol/L的KMnO4溶液.
(1)写出用KMnO4滴定H2C2O4的离子方程式 .
(2)判断滴定终点的方法是 .
(3)③步骤中取酸性KMnO4溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数(填“偏大”、“偏小”或“无影响”).
(4)计算:血液中含钙离子的浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是
A. 苯的硝化反应的化学方程式:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O
+H2O
B. 电解饱和氯化铜溶液(惰性电极)的阳极反应式:Cu2++2e-=Cu
C. 打磨过的镁条与热水反应的离子反应式:Mg+2H+=Mg2++H2↑
D. 燃煤烟气用氨水法脱硫的化学反应式:4NH3·H20+2SO2+O2=2(NH4)2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《中国诗词大会》不仅弘扬了中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“ 乌金”指的是石油
C. 赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com