
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO32- |
B |
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D
【答案】C
【解析】A. 向溶液X中滴加BaCl2溶液,有白色沉淀生成,溶液X中可能含有SO42-、CO32-、SiO32-、SO32-等等,A正确;B.该实验中过量的铜和混酸发生反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,混酸中NO3-和H+ 的物质的量之比恰好为1:4,故反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO ,B正确; C. 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色,由于只有少量的AgNO3溶液,说明只有碘化银沉淀生成,故Ksp(AgCl)>Ksp(AgI),C不正确; D. HSO3-是弱酸的酸式根离子,其既能电离又能水解,室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5,说明HSO3-的电离程度大于其水解程度,D正确。本题选C。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
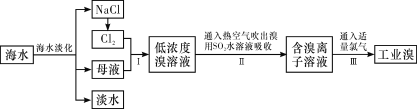
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______________。写出步骤Ⅱ中发生反应的离子方程式:________________________________。
(3)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:__________________。
(4)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的_____。(填选项)
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气用于工业合成氨 N2(g)+3H2(g)2NH3(g);△H=﹣92.2kJmol﹣1 . 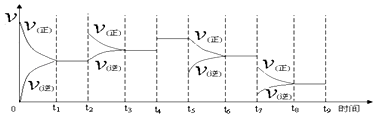
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是
t4 .
t5 .
t7 .
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,此时放出热量46.1kJ.则n= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3﹣、MnO4﹣
B.K+、Na+、Cl﹣、SO42﹣
C.K+、Na+、Br﹣、Cu2+
D.Na+、Ba2+、OH﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液中存在如下反应:CO ![]() +H2O═HCO
+H2O═HCO ![]() +OH﹣下列说法中正确的是( )
+OH﹣下列说法中正确的是( )
A.溶液中加水, ![]() 增大
增大
B.加入Na2CO3固体, ![]() 减小
减小
C.升高温度,平衡常数减小
D.通入CO2 , 溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( ) 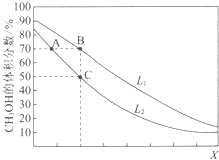
A.X代表压强
B.L1<L2
C.平衡常数:K(A)=K(B)
D.在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.固体氯化钠不导电,所以氯化钠是非电解质
B.铜丝能导电,所以铜是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.SO3溶于水能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验: 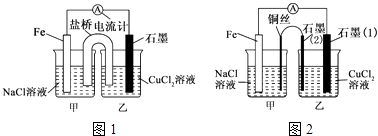
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .
(4)在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用铬,通常采用如下流程处理:
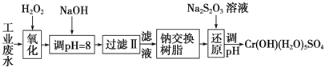
注:部分阳离子常温下沉淀时的pH见下表
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀pH | 1.4 | 7 | 9.1 | 3.4 | 4.3 |
完全沉淀pH | 3.7 | 9.6 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:________________;其中Cr3+被氧化为Cr2O72-,该反应的离子方程式为:____________,氧化Cr3+的目的是__________。
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是_____。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com