
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(B)=0.3 mol·L-1· s-1B. v(A)=0.5mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=30 mol·L-1·min-1
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
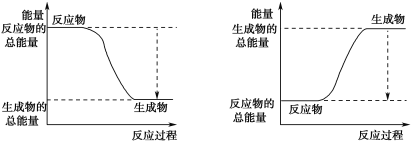
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)![]() H2(g)+I2(g),减小容器体积,气体颜色变深
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一事实能说明生物界与非生物界具有统一性
A. 生物与非生物都具有化学变化
B. 生物与非生物都由元素构成
C. 组成生物体的化学元素在无机自然界中都可以找到
D. 生物与非生物都含有碳元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,又是一种重要的化工原料.具有广阔的开发和应用前景。工业上可用如下方法合成甲醇:CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).
(1) 已知:①2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
②2CO(g)+O2(g)![]() 2CO2(g)△H=-566.0kJ·mol-1;
2CO2(g)△H=-566.0kJ·mol-1;
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为__________。
(2) 在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
①前5min内甲醇的平均反应速率为__________;已知该反应在低温下能自发进行,则反应的△H_______0(填“>”“<”或“=”)。
②在该温度下反应的平衡常数K=__________。
③某时刻向该平衡体系中加人CO、H2、CH3OH各0.2mol后,则v正__________v逆(填“>”“=”或“<”)。
④当反应达到平衡时,__________(填字母)。
a.混合气体的压强不再发生变化 b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、 氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在__________腔中,该腔中的电极反应式为__________.
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为__________(法拉第常数F=9.65×104C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
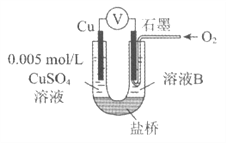
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在细胞内含量极少,但对维持生命活动必不可少的元素有
A. Fe Mn Zn Mg B. Zn Cu Mg Ca
C. Zn Cu B Mn D. Mg Mn Cu Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的甲烷燃烧后得到的产物为CO、CO 2 和水蒸气,此混合气体质量为 49.6 g ,当其缓慢经过无水氯化钙(足量)时,氯化钙增重 25.2 g ,则原混合气体中CO 的质量为( )
A. 26.4 g B. 19.7 g C. 13.2 g D. 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,aA+bB![]() cC的可逆反应达到平衡:
cC的可逆反应达到平衡:
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则a、b、c的关系是:_____。
(2)已知A为固体、B为无色气体、C是有色气体,且(a+b)=c,在加压时,平衡向____方向移动,气体的颜色将___(填“加深”或“变浅”或“不变”)。
(3)加热后C的质量分数减少,则正反应是___热反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com