
在一定条件下发生反应3A(g)+2B(g) zC(g)+2D(g),在2L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得反应速率v(D)=0.2 mol·L–1 ·min–1 。则下列说法不正确的是( )
zC(g)+2D(g),在2L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得反应速率v(D)=0.2 mol·L–1 ·min–1 。则下列说法不正确的是( )
A.z=4
B.B的转化率是40%
C.A的平衡浓度是1.4 mol·L–1
D.平衡时气体压强是原来的1. 2倍
2倍
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2015-2016学年吉林省松原市高一下期末化学试卷(解析版) 题型:选择题
由反应物X分别转化为Y和Z的能量变化如图所示。下列说法正确的是

A.由 反应的ΔH=E5?E2
反应的ΔH=E5?E2
B.由 反应的ΔH>0
反应的ΔH>0
C.增大压强有利于提高Y的产率
D.降低温度有利于提高Z的产率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二下期末化学试卷(解析版) 题型:实验题
某同学通过以下装置测定M 样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质 量均为m g 的M 样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL 和V2 mL(已折算到标准状况下)。
量均为m g 的M 样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL 和V2 mL(已折算到标准状况下)。
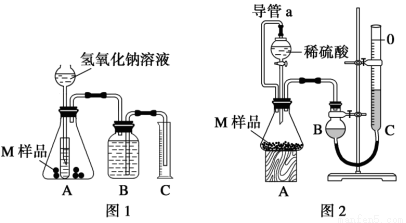
(1)实验1 装置中小试管的作用是_______________。
(2)对于实验2,平视读数前应依次进行的两种操作是:
①______________;②________________________。
(3)实验1 进行实验前,B 瓶中水没有装满,使测得气体体积_____ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2 中导管a,使测得气体体积_____________。
(4)该实验需要0.50 mol·L-1 的NaOH 溶液470 mL,请回答下列问题
①配制时应称量______g NaOH,配制过程所需仪器____________ (填仪器名称)。
②配制NaOH 溶液时,NaOH 固体中含有Na2O 杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(5)该实验中所用稀硫酸是用98%的浓硫酸(ρ =1.84g/cm3)配制的,若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度_________9.2mol/L(填>、<、=)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二下期末化学试卷(解析版) 题型:选择题
下列各组离子,在水溶液中能大量共存的是( )

A.(1)和(6) B.(3)和(4) C.(2)和(4) D.(2)和(5)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南师大附中高二下期末理综化学试卷(解析版) 题型:简答题
合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)氧化—还原法消除氮氧化物的 转化如下:
转化如下: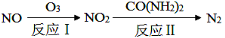
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是_____。
(2)硝化法是一种古老的生 产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)
产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料一定条件下发生反应:CO(NH2)2 (s) + H2O(l) 2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
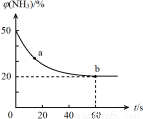
②密闭容器中以等物质的量的NH3和CO2为原料,在120 ℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g) CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东济南一中高一下期末化学试卷(解析版) 题型:实验题
已知有机物A能发生以下转化,并且A可以作为水果的催熟剂,在一定条件下A可以发生自身加成反应,形成高分子化合物E。
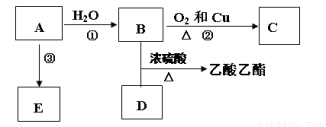
(1)写出E的结构简式______________,E______(填“能”或“不能”)使酸性KMnO4溶液褪色。
(2)请写出C的名称是______________,D分子中的官能团名称是___________。
(3)请写出反应②以及B与D发生反应的化学方程式,并注明反应类型:
② ________________________________,反应类型_____________;
B+D ______________________________,反应类型_____________。
(4)若完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g。该烃的化学式 ,并写出其所有可能的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东济南一中高一下期末化学试卷(解析版) 题型:选择题
可逆反应:2NO2(g)  2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmol O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A.①④ B.②③⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东济南一中高二下期末化学试卷(解析版) 题型:填空题
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生反应是2Cu+===Cu2++Cu 。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 (填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式 。
(3)CuH溶液在稀盐酸中生成的气体是 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com