
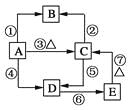
【题目】已知硅及其化合物之间存在如图转化关系。其中A是制造芯片和光电池的主要原料;B是含硅化合物中的一种气体;某些C可作干燥剂或催化剂的载体;D是一种黏合剂,能将磨砂玻璃黏合在一起,E是一种比H2CO3酸性还弱的酸。
试回答下列问题:
(1)写出A、C、E的化学式:A________、C________、E________。
(2)①~⑦反应中,属于氧化还原反应的是________,属于置换反应的是______,属于离子反应的是________。
【答案】Si SiO2 H2SiO3 ①③④ ①④ ④⑤⑥
【解析】
解题流程:
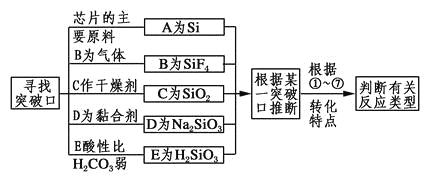
①~⑦反应分别是:
①Si+4HF===SiF4↑+2H2↑。是氧化还原反应,也是置换反应,不是离子反应(氢氟酸是弱酸,在溶液中HF的电离微弱,不能拆为离子形式);
②SiO2+4HF===SiF4↑+2H2O。不是氧化还原反应,不是置换反应,也不是离子反应;
③Si+O2===SiO2是氧化还原反应,不是置换反应,也不是离子反应;
④Si+2NaOH+H2O===Na2SiO3+2H2↑(Si+2OH+H2O===SiO32-+2H2↑)。是氧化还原反应,是置换反应(有单质和化合物参加,也有单质和化合物生成),也是离子反应;
⑤2NaOH+SiO2===Na2SiO3+H2O(2OH+SiO2=== SiO32-+H2O)。不是氧化还原反应,也不是置换反应,是离子反应;
⑥Na2SiO3+2HCl===2NaCl+H2SiO3↓(SiO32-+2H+===H2SiO3↓)。不是氧化还原反应,也不是置换反应,是离子反应;
⑦H2SiO3![]() H2O+SiO2。不是氧化还原反应,不是置换反应,也不是离子反应。
H2O+SiO2。不是氧化还原反应,不是置换反应,也不是离子反应。
综合以上分析,①~⑦反应中,属于氧化还原反应的是①③④,属于置换反应的是①④,属于离子反应的是④⑤⑥。


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如下图所示的转化关系:
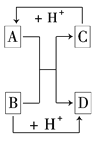
(1)如果A、B、C、D均是10电子的粒子,请写出:
A的电子式_____________;D的电子式____________;
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式:____________________________________
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A. 2s末氨气的反应速率=0.4mol·(L·s)-1
B. 前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C. 前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D. 2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,m为单质,d是淡黄色粉末,b是生活中常见的液态化合物。上述物质的转化关系如图所示。下列说法正确的是

A. 化合物a中只含有C、H两种元素
B. 几种元素的原子半径由大到小顺序为Z>Y>X>W
C. d是离子化合物,阴阳离子个数比为1:2
D. Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列五个反应
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
E.MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
上述反应中氯元素只被氧化的是_____________,(填字母,下同)只被还原的是_____________,部分被氧化的是_____________,C中被氧化与被还原的物质的量之比为_____________。
(2)在反应4(NH4)2SO4![]() N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10A1+6NaNO3+4NaOH==10NaA1O2+3N2↑+2H2O。上述反应中,若产生2mol N2,转移电子数为_________(用NA表示阿伏加德罗常数);用“双线桥”表示反应中电子转移,化合价的变化,反应类型:______________。
(4)将等质量的两份镁、铝合金分别投入足量的NaOH和HCl中,在相同的情况下测得生成气体的体积之比为1:2,求合金中镁、铝的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是另一种元素周期表——三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是
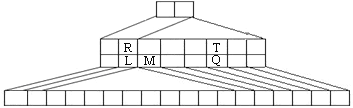
A.Q、T两元素的氢化物的稳定性为HnT<HnQ
B.L、R的单质与盐酸反应速率为R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CO、CO2的应用和治理是当今社会的热点问题。
CO工业上可用于高炉炼铁,发生如下反应: 1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是____(选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
II.合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)+Q(Q>0)。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。
一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.2υ正(NH3)=υ逆(H2O) b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101 kPa d.24000 kPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B. 已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2
C. 已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
D. 已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表中完整周期元素的性质,完成下列空格。
(1)在第三周期中,第一电离能最小的元素符号是________,其原子的结构示意图为__________,第一电离能最大的元素符号是________,其价电子排布式为___________________________。
(2)在元素周期表中,电负性最大的元素名称是________,其价电子排布图为______________
(3)第四周期元素中未成对电子数最多的元素符号是________,其原子的简化电子排布式为__________,有_____个未成对电子,有_____个能级,能量最高的能级符号为_______。
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是_________,原子中所有电子占有________个轨道,核外共有________个不同运动状态的电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com