
�����йؼ���ķ�����ȷ����
A��ij��Һ100mL�����к�����0.03mol������0.04mol�����ڸ���Һ��Ͷ��1.92 gͭ���ȣ���Ӧ��ų�һ����������ԼΪ0.015mol
B������ʱ�����ݻ�Ϊa mL���Թ��г���NO2���壬Ȼ������ˮ�е�����ˮ�治������ʱΪֹ����ͨ��b mL O2�������Һ���ּ�������������Թ������ʣ������Ϊc mL���Ҹ����岻��֧��ȼ�գ���a��b�Ĺ�ϵ��a=4b+c
C����֪ij�¶�Ksp(Ag2S)=6��10-50,Ksp(AgCl)=2��10-6����2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)��ƽ�ⳣ��ԼΪ6.7��10-37
Ag2S(s)+2Cl-(aq)��ƽ�ⳣ��ԼΪ6.7��10-37
D����25 ���£���2a mol��L��1�İ�ˮ��0.02 mol��L��1������������ϣ���Ӧ��ȫʱ��Һ��c(NH4+)��c(Cl��)�����ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣�� 
D
��������
���������A��ij��Һ100mL�����к�����0.03mol������0.04mol�������������ʵ�����0.1mol�����ڸ���Һ��Ͷ��1.92 gͭ�ۼ�0.03molͭ�ȣ����ݷ���ʽ8H����3Cu��2NO3����3Cu2����4H2O��2NO����֪��Ӧ��������������ӹ�������Ӧ��ų�һ����������ԼΪ0.02mol��A����B������ʱ�����ݻ�Ϊa mL���Թ��г���NO2���壬Ȼ������ˮ�е�����ˮ�治������ʱΪֹ����ͨ��b mL O2�������Һ���ּ�������������Թ������ʣ������Ϊc mL���Ҹ����岻��֧��ȼ�գ���˵��ʣ��������NO������ݷ���ʽ4NO2��O2��2H2O��4HNO3��3NO2��H2O��HNO3��2NO��֪4b��1.5c��a��B����C����֪ij�¶�Ksp(Ag2S)=6��10-50,Ksp(AgCl)=2��10-6����2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)��ƽ�ⳣ����
Ag2S(s)+2Cl-(aq)��ƽ�ⳣ���� 6.7��1037��C����D����25 ���£���2a mol��L��1�İ�ˮ��0.02 mol��L��1������������ϣ���Ӧ��ȫʱ��Һ��c(NH4+)��c(Cl��)������ݵ���غ��֪��Һ�����ԣ���Һ��c(NH4+)��c(Cl��)��0.01mol/L��һˮ�ϰ���Ũ����amol/L��0.01mol/L������ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��
6.7��1037��C����D����25 ���£���2a mol��L��1�İ�ˮ��0.02 mol��L��1������������ϣ���Ӧ��ȫʱ��Һ��c(NH4+)��c(Cl��)������ݵ���غ��֪��Һ�����ԣ���Һ��c(NH4+)��c(Cl��)��0.01mol/L��һˮ�ϰ���Ũ����amol/L��0.01mol/L������ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��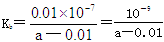 ��D��ȷ����ѡD��
��D��ȷ����ѡD��
���㣺���黯ѧ��Ӧ����
��������� ����1��������ԭ��Ӧ ����2��������ʵĵ��� ����3���ܽ�ƽ�� ����4������Ũ�ȱȽ� ��������

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ��̨�и�����ѧ��һģ��ϲ��������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶�ѹǿ�£����ݻ��ɱ���ܱ������з�����ӦCO(g)+H2O(g) CO2(g)+H2(g) ��H��0��������˵������ȷ����
CO2(g)+H2(g) ��H��0��������˵������ȷ����
A�������������䣬�Ӵ����벻�Ӵ����䦤H ��ͬ
B�����ﵽƽ�⣬����ϵ�г���CO2��ƽ�������ƶ�
C�������ϸ÷�Ӧ����Ƴ�ȼ�ϵ�أ�H2O(g)�������Ϸ�����ԭ��Ӧ
D��ƽ��������ͨ��NaOH��Һǡ�÷�Ӧ�������¶���Һ������ǿ����pHһ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ�����и���3��ģ�⿼�������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣�ijú����Ҫ����Al2O3��SiO2�����Ʊ���ʽ������[Al2(SO4)3��2Al(OH)3]��Һ����������������SO2���ŷţ����Ʊ����̣�

��֪��25�棬Ksp��CaCO3����2.8��10��9 �� Ksp��CaSO4����9.1��10��6��
��1�������ٵ����� ��
��2�����ʱ��Ӧ�����ӷ���ʽΪ ��Ϊ��������ʱ��Ԫ�صĽ����ʣ��ɲ�ȡ�Ĵ�ʩ____________________��___________________��д2������
��3������2�Ļ�ѧʽ�� ���Է�������2���ɵ���Ҫԭ�������ӷ���ʽ������ּ�Ҫ˵���� ��
��4����ʽ��������Һ����SO2����Al2(SO4)3��Al2(SO3)3���������Һͨ����������������һ�������Σ������Ʊ���ʽ��������Һ��ѭ��ʹ�ã���д���йط�Ӧ�Ļ�ѧ����ʽ�� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ������ѧ��3���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں����ܱ�������ͨ��X��������Ӧ��2X(g) Y(g)���¶�T1��T2��X�����ʵ���Ũ��c(x)��ʱ��t�仯��������ͼ��ʾ������������ȷ����
Y(g)���¶�T1��T2��X�����ʵ���Ũ��c(x)��ʱ��t�仯��������ͼ��ʾ������������ȷ����
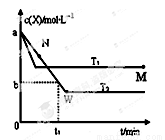
A���÷�Ӧ���е�M��ų����������ڽ��е�W��ų�������
B��T2�£���0��t1ʱ���ڣ�v(Y)�� mol/(L��min)
mol/(L��min)
C��M�������Ӧ����v������N����淴Ӧ����v��
D��M��ʱ�ټ���һ������X��ƽ���X��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ��У����3��������ѧ�Ծ��������棩 ���ͣ������
ѡ��[��ѧ��ѡ��ѧ�뼼��]��15�֣�
ͨ������£���������CO2�������������0.050%ʱ�����������Ե�����ЧӦ��Ϊ��С������CO2�Ի�����Ӱ�죬������������CO2��������ͬʱҲ��ǿ��CO2�������õ��о���
��1��Ŀǰ���ƹ��ó��ٽ�CO2��������̬��Һ̬֮�䣩��������������������һ�����Ի����Ļ��������� ��
��2����ѧ��Ϊ��ȡ�����е�CO2���ѿ�������̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧʹ֮��Ϊ������ȼ�ϼ״���������ͼ��

�ٷֽ���з�Ӧ�Ļ�ѧ����ʽΪ�� ��
�ںϳ����У�����4.4g CO2������H2ǡ�÷�Ӧ������̬����ų�4.947kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��3��ijͬѧ���ó������ⶨ������CO2����������������CaCO3��BaCO3���ܶȻ�Ksp�ֱ�Ϊ4.96��10-9��2.58��10-9������ý�����ͨ�������� ��Һ��ʵ��ʱ���ⶨ�¶ȡ�ѹǿ�Ϳ���������⣬����ⶨ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ��У����3��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����ⷨ����ͭ����������������32 gʱ��һ����6.02��1023������ת��
B����10.6 g Na2CO3����Һ�У�������������������6.02��1022
C��28 g����ϩ�͵�����ɵĻ�������У�����6.02��1023��ԭ��
D����0.2 mol H2SO4��Ũ����������ͭ��Ӧ������SO2�ķ�����Ϊ6.02��1022
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ����������ظ���һģ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���н���ʵ����ʵ�ķ���ʽ��ȷ����
A��Al2(SO4)3��Һ�μӰ�ˮ������ɫ��״������Al3+ + 3OH�� = Al(OH)3 ��
B��90��ʱ��ô�ˮ��c(H+)��c(OH��) =3.8��10-13��H2O(l) H+(aq) + OH��(aq) ��H��0
H+(aq) + OH��(aq) ��H��0
C��FeCl3��Һ��ͨ��SO2����Һ��ɫ��ȥ��2Fe3++SO2 +2H2O = 2Fe2+ + SO42��+ 4H+
D��̼������Һ�����̪��죺CO32��+ 2H2O  H2CO3 + 2OH��
H2CO3 + 2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ���н̿���Э�������3��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���з���ʽ��ʾ���л����У����������ŵ�ͬ���칹����Ŀ������
A��C4H10O B��C4H10 C�� C3H6O D�� C4H7Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ�����и���3��������黯ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����л���ı�����ȷ����
A����֬��ˮ�����ɱ�����
B���Ҵ�����ԭ��������ȩ
C����ϩ�뱽����ʹ���Ը��������Һ��ɫ
D�����ۡ���������ȫˮ��IJ��ﻥΪͬ���칹��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com