
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A.x=1
B.B的转化率为40%
C.2min内A的反应速率为0.6mol·L-1·min-1
D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
【答案】C
【解析】
平衡时生成C的物质的量为0.2mol·L-1×2L=0.4mol,物质的量之比等于化学计量系数之比,所以0.4mol:0.8mol= x:2,解得x=1;依据化学平衡三段式列式计算:
3A(g)+B(g)![]() C(g)+2D(g)
C(g)+2D(g)![]()

A.由分析可知x=1,故A正确;
B.根据三段式,B的转化率=![]() ,故B正确;
,故B正确;
C.根据速率计算公式,2min内A的反应速率=![]() 0.4mol·L-1·min-1,故C错误;
0.4mol·L-1·min-1,故C错误;
D.混合气体的平均相对分子质量=混合气体的总质量/混合气体的总物质的量,根据质量守恒定律,混合气体的总质量始终保持不变,根据方程式系数关系可知,混合气体的总物质的量是可变量,推出混合气体的平均相对分子质量也是可变量,所以当混合气体的平均相对分子质量不变时,说明反应达到化学平衡状态,故D正确;
答案为C。


科目:高中化学 来源: 题型:
【题目】工业上制备下列物质的生产流程合理的是( )
A. 由铝土矿冶炼铝:铝土矿![]() Al2O3
Al2O3![]() AlCl3
AlCl3![]() Al
Al
B. 从海水中提取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. 由NaCl制漂白粉:饱和食盐水![]() Cl2
Cl2![]() 漂白粉
漂白粉
D. 由黄铁矿制硫酸:黄铁矿![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有一反应:3Fe2++2S2O32—+O2+xOH-===Fe3O4+S4O62—+2H2O,下列说法中不正确的是( )
A.x=4
B.1molFe2+被氧化时,被Fe2+还原的O2的物质的量为![]() mol
mol
C.Fe2+和S2O32—都是还原剂
D.每生成1molFe3O4,反应转移的总电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+4B(g)![]() 2C(g)+2D(g),下列数据表示反应进行得最快的是( )
2C(g)+2D(g),下列数据表示反应进行得最快的是( )
A.v(A)=1.4mol/(Ls)B.v(B)=3.6 mol/(Ls)
C.v(C)=2mol/(Ls)D.v(D)=30 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。

已知: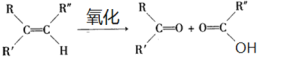
(1)B和A为同系物,B的结构简式为_________________;
(2)反应①的化学方程式为__________________,其反应类型为___________;
(3)写出检验C3H5Cl中含有Cl原子的方法:______________;
(4)C的结构简式为______________;
(5)反应④的化学方程式为_______________;
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)____________。(合成路线格式如下:CH3CH2OH ![]() H2C=CH2
H2C=CH2 ![]() BrCH2CH2Br)
BrCH2CH2Br)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( )
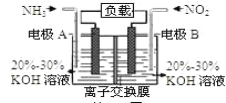
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol
D.电极A极反应式为2NH3-6e-=N2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
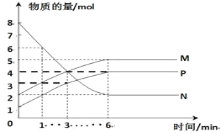
(1)反应化学方程式中各物质的系数比为a:b:c=______。
(2)1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_____。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗amolN,同时消耗bmolM
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据见下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是______________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___________________,但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
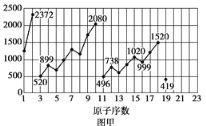
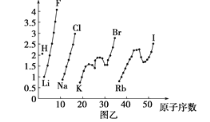
A. 图乙不可能表示元素的电负性随原子序数的变化关系
B. 图甲可能表示的是元素单质的熔点随原子序数的变化关系
C. 图乙可能表示的是元素原子的半径随原子序数的变化关系
D. 图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com