
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
【答案】 0.3mol/(L·min) B -90.3 K1·K2·K3 A
【解析】(1). ①. 由图象可知,从反应开始到5min,CO浓度的变化量为2mol/L0.5mol/L=1.5mol/L,则从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=1.5mol/L÷5min=0.3mol/(Lmin),故答案为:0.3mol/(Lmin);
②. A. 根据三段式法列式计算:
CO(g)+2H2(g) ![]() CH3OH(g),
CH3OH(g),
起始(mol): 2 4 0
转化(mol): 1.5 3 1.5
平衡(mol): 0.5 1 1.5,达到平衡时,H2的转化率=![]() ×100%=
×100%=![]() ×100%=75%,故A错误;B. 由反应方程式可知,反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,故B正确;C. 达到平衡后,再充人氩气,总压增大,但分压不变,所以反应速率不变,故C错误;D. 在2min前后反应未达到平衡状态,由图可知,反应正向进行,v(正)>v(逆),故D错误;答案选B;
×100%=75%,故A错误;B. 由反应方程式可知,反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,故B正确;C. 达到平衡后,再充人氩气,总压增大,但分压不变,所以反应速率不变,故C错误;D. 在2min前后反应未达到平衡状态,由图可知,反应正向进行,v(正)>v(逆),故D错误;答案选B;
(2). ①. 由盖斯定律可知,I+II+III得反应:C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),则该反应的△H等于反应I、Ⅱ、Ⅲ的△H之和,所以反应△H=(+131.0kJ/mol)+(43kJ/mol)+(178.3kJ/mol)=90.3kJ/mol,平衡常数K等于I、Ⅱ、Ⅲ的K之积,即K=K1×K2×K3,故答案为:90.3;K1K2K3;
CaCO3(s)+2H2(g),则该反应的△H等于反应I、Ⅱ、Ⅲ的△H之和,所以反应△H=(+131.0kJ/mol)+(43kJ/mol)+(178.3kJ/mol)=90.3kJ/mol,平衡常数K等于I、Ⅱ、Ⅲ的K之积,即K=K1×K2×K3,故答案为:90.3;K1K2K3;
②. A. 可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)为放热反应,降低温度,平衡正向移动,H2产率增大,故A正确;B. C(s)+2H2O(g)+CaO(s)
CaCO3(s)+2H2(g)为放热反应,降低温度,平衡正向移动,H2产率增大,故A正确;B. C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)为反应前后气体体积不变的可逆反应,缩小容器的体积,压强增大,平衡不移动,H2产率不变,故B错误;C. 因为CaO是固体,增加CaO的量,平衡不移动,H2产率不变,故C错误;D. 选用适当的催化剂,平衡不移动,H2产率不变,故D错误;答案选A。
CaCO3(s)+2H2(g)为反应前后气体体积不变的可逆反应,缩小容器的体积,压强增大,平衡不移动,H2产率不变,故B错误;C. 因为CaO是固体,增加CaO的量,平衡不移动,H2产率不变,故C错误;D. 选用适当的催化剂,平衡不移动,H2产率不变,故D错误;答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】蒸馏水的制取:如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。

(1)A仪器的名称是________,B仪器的名称是________。
(2)实验时A中除加入少量自来水外,还需加入少量________,其作用是___________。
(3)指出图中两处明显的错误,并改正:
①____________________;
②______________________。
(4)收集完蒸馏水后,是先撤酒精灯还是先关闭冷凝水?____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
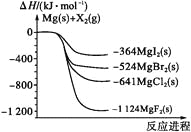
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分含Fe元素的徽粒在溶液中的物质的量分数与溶液pH的关系如图所示,下列说法正确的是

A. HFeO4-在水中的电离程度小于水解程度
B. B、C两点对应溶液中水的电离程度:B > C
C. B点溶液加适里水稀释,溶液中所有离子浓度均减小
D. 由A点数据可知,H2FeO4的第一步电离平衡常数Ka1=4.15×l0-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以2氯丙烷为主要原料制1,2丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为( )
A. 加成反应→消去反应→取代反应
B. 消去反应→加成反应→取代反应
C. 消去反应→取代反应→加成反应
D. 取代反应→加成反应→消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如下图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是

A. 氧气在石墨电极上发生氧化反应
B. 该电池的石墨电极是负极
C. 该电池放电时电子经氢氧化钾溶液向石墨电极移动
D. 该电池的负极反应为Zn-2e-+2OH-=ZnO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是
A. 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L
B. 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2
C. 原混合气体中NO在标准状况下的体积可能为16. 8 L
D. 在用氨气处理氮氧化物时,氮氧化物发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<![]()
B. 浓度为0.1mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO32-)
C. 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D. 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液存在较多的阳离子是( )
A.Cu2+
B.Fe3+
C.Fe2+
D.H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com