
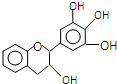
 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 该有机物的分子式是C15H13O5 | |
| B. | 1mol EGC与4molNa生成气体体积为44.8L | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 分子中所有的原子共面 |
分析 该分子中含有苯环、醚键、醇羟基、酚羟基,具有苯、醚、醇和酚的性质,能发生氧化反应、加成反应、消去反应、取代反应等,
A.根据结构简式确定分子式;
B.温度和压强未知,导致气体摩尔体积未知;
C.酚羟基易发生取代反应、氧化反应,但苯环难发生加成反应;
D.与苯环直接的原子在同一平面内,-CH2-为四面体结构.
解答 解:A.根据结构简式确定分子式为C15H14O7,故A错误;
B.温度和压强未知,导致气体摩尔体积未知,所以无法计算生成氢气体积,故B错误;
C.酚羟基易发生取代反应、氧化反应,但苯环难发生加成反应,需要催化剂条件,故C正确;
D.与苯环直接的原子在同一平面内,-CH2-为四面体结构,由中间环上的碳原子可知,分子中所有的原子一定不能共平面,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系,易错选项是B,注意气体摩尔体积适用范围及适用条件,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$
$→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$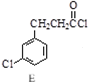 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$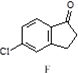
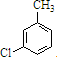 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.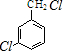 +3NaOH$→_{催化剂}^{高温、高压}$
+3NaOH$→_{催化剂}^{高温、高压}$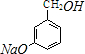 +2NaCl+H2O.
+2NaCl+H2O. (任写一种).
(任写一种). .
.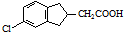 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: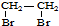
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第VIIA族元素由上至下其单质的沸点依次升高 | |
| B. | 第VIA族元素的最高化合价都为+6价 | |
| C. | 离核越远的电子层上的电子能量越低 | |
| D. | 所有元素的原子中都含有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律(或性质) | 结 论 |
| A | 主族元素最高正化合价等于族序数 | 第VⅡA族元素最高正价都是+7 |
| B | SO2和湿润的Cl2都有漂白性 | 二者混合后漂白性更强 |
| C | 常湿下铜与浓硝酸反应可以制取NO2 | 常温下铁与浓硝酸反应也可以制取NO2 |
| D | 较强酸可以制取较弱酸 | CO2通入NaClO溶液液中能生成HC10 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
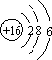 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
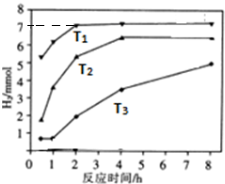
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com