
(16分)海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的过程之一。请回答下列问题。

(1)下列有关说法正确的是________(填字母序号)。
a.在第③、④、⑤步骤中,溴元素均被氧化
b.用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.可以用海滩上的贝壳制取的Ca(OH)2使母液中的Mg2+沉淀下来
d.步骤 ① 除去Ca2+、Mg2+、SO42-加入试剂的先后顺序为NaOH、Na2CO3、BaCl2
(2)工业上以NaCl、NH3、CO2等为原料先制得NaHCO3,反应的化学方程式为:
NaCl + NH3 + CO2 + H2O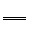 NaHCO3↓+ NH4Cl,进而生产纯碱。
NaHCO3↓+ NH4Cl,进而生产纯碱。
某活动小组根据上述原理,制备碳酸氢钠。实验装置如下图所示(夹持、固定用的仪器未画出)。

乙装置中的试剂是 ;实验中分离出NaHCO3晶体的操作是________(填分离操作名称),该操作所需要的玻璃仪器有______________________。
(3)工业上利用电解饱和食盐水可制得重要化工产品:NaOH溶液和Cl2,又称为“氯碱工业”。将电解生成的Cl2通入NaOH溶液中可得到一种消毒液,写出该反应的离子方程式 。
该活动小组中甲、乙两位同学利用制得的Cl2按下图装置继续进行实验:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: ,
其有关反应的离子方程式为 。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的? 。
(16分)
(1)c (2)饱和NaHCO3溶液 ; 过滤 ; 玻璃棒、漏斗、烧杯
(3)Cl2+2OH-=== Cl-+ClO-+H2O
①控制SO2和Cl2按物质的量之比1:1 进气; SO2 +Cl2 +2H2O =SO42-+2Cl-+4H+
②控制SO2和Cl2进气的物质的量,使之不相等
【解析】
试题分析:(1) a.第④步的反应为SO2+2H2O+Br2=H2SO4 +2HBr,溴元素的化合价降低被还原,错误;b. 分别向Na2CO3 和NaHCO3 溶液中加入澄清石灰水,发生反应为Na2CO3+Ca(OH)2=2NaOH+CaCO3↓、2NaHCO3 +Ca(OH)2=Na2CO3+CaCO3↓+2H2O,均有白色沉淀产生,无法鉴别,错误;c.贝壳的主要成分是CaCO3 ,煅烧贝壳生成CaO,CaO+H2O = Ca(OH)2 ,Ca(OH)2 +Mg2+=Ca2++Mg(OH)2 ,所以可以用海滩上的贝壳制取的Ca(OH)2使母液中的Mg2+沉淀下来,正确;d. 根据溶液中的杂质离子为钙离子、镁离子和硫酸根离子,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,这样可以将过量的钡离子沉淀除去,最后再用盐酸中和溶液中的碳酸根离子和氢氧根离子,错误;选c。
(2)利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过饱和碳酸氢钠的溶液是为了除掉气体中的氯化氢气体,所以乙装置中的试剂是饱和碳酸氢钠的溶液;分离出NaHCO3 晶体的操作是分离固体与液体,常采用的实验操作是过滤操作;该操作所需要的玻璃仪器为玻璃棒、漏斗、烧杯。
(3)将电解生成的Cl2通入NaOH溶液中可得到一种消毒液,该消毒液是NaClO溶液,氯元素的化合价升高,必然有一部分氯元素的化合价由0价降低到-1价,所以氯气和NaOH溶液反应生成氯化钠、次氯酸钠和水,该反应的离子方程式为Cl2+2OH-=== Cl-+ClO-+H2O。
①甲同学实验过程中,品红溶液不褪色,说明没有SO2 进入品红溶液,而SO2 与浓硫酸不反应,只能是SO2 和氯气在浓硫酸的环境中发生反应消耗掉,即SO2 +Cl2 +2H2O =H2SO4 +2HCl,所以甲同学实验过程中,品红溶液不褪色的原因是控制SO2和Cl2按物质的量之比1:1 进气;其有关反应的离子方程式为SO2 +Cl2 +2H2O =SO42-+2Cl-+4H+;
②无论是SO2 还是氯气都能使品红溶液褪色,所以乙同学是通过控制SO2和Cl2进气的物质的量,使之不相等,让品红溶液变得越来越浅的。
考点:考查海水资源的综合利用,侯德榜制碱法的化学原理,SO2和氯气的化学性质等知识。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2014-2015江苏省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.在标准状况下,氯气的密度约为3.17g/L
B.密闭容器中的氯水放置数天后,PH变小且几乎失去漂白性
C.液氯具有漂白性,干燥的氯气和液氯均能使干燥的有色布条褪色
D.在通常情况下,氯气可以和某些金属直接化合
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省聊城市茌平等三县高二上学期期末联考化学试卷(解析版) 题型:填空题
(共8分)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是____:电解质溶液Y的溶质是____:
(2)银电极为电池的____极,发生的电极反应为____;x电极上发生的电极反应为____;
(3)盐桥中装有含琼胶的KNO3 饱和溶液,则盐桥中NO3-移向____。(填“左侧烧杯”或“右侧烧杯”)
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省聊城市茌平等三县高二上学期期末联考化学试卷(解析版) 题型:选择题
25℃时,相同物质的量浓度的下列溶液:
其中水的电离程度按由大到小顺序排列的一组是
A.④>③>②>① B.②>③>①>④
C.③>②>①>④ D.④>①>②>③
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省聊城市茌平等三县高二上学期期末联考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石)  可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
C.一定条件下,将0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:
D.在稀溶液中, ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省菏泽市高一上学期期末考试化学A试卷(解析版) 题型:选择题
下列分离或提纯物质的方法正确的是
A.用渗析的方法精制Fe(OH)3胶体
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省菏泽市高一上学期期末考试化学A试卷(解析版) 题型:选择题
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色(淀粉遇I2变蓝)。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2 > Fe3+ > I2
B.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
C.上述实验中,共有两个氧化还原反应
D.实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
下列叙述正确的是

A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
B. 的正、逆反应的平衡常数K随温度的变化可用上图表示
的正、逆反应的平衡常数K随温度的变化可用上图表示
C. ,常温下该反应一定能自发进行
,常温下该反应一定能自发进行
D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:选择题
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com