
����Ŀ����Ҫ������
(1)����(CH4)��Ħ������Ϊ_________��
(2)0.5mol H2������Ϊ______����״���¸���������Ϊ_________��
(3)5molCO2������ԭ�ӵ���ĿΪ__________����
(4)100mL0.25mol/L Na2SO4��Һ��Na+�����ʵ���Ũ����__________mol/L��
(5)��200mL�Ȼ�þ���Ȼ����Ļ����Һ������c(Mg2+)Ϊ0.2mol/L��c(Cl��)Ϊ1.6mol/L����Al3+�����ʵ���Ũ��Ϊ______________mol/L��
���𰸡�16 g/mol 1 g 11.2 L 10NA ����6.02��1024�� 0.5 0.4
��������
(1) Ħ��������g/molΪ��λ����ֵ�ϵ�����Է������������Լ���(CH4)��Ħ������Ϊ16 g/mol���𰸣�16 g/mol��
(2)����m=n![]() M=0.5mol
M=0.5mol ![]() 2 g/mol =1g������0.5molH2������Ϊ1g����״���¸���������ΪV=nVm=0.5mol
2 g/mol =1g������0.5molH2������Ϊ1g����״���¸���������ΪV=nVm=0.5mol ![]() L/mol=11.2 L���𰸣�1 g ��11.2 L��
L/mol=11.2 L���𰸣�1 g ��11.2 L��
(3)����N=nNA=5mol![]() 2
2![]() 6.02��1023mol-1=6.02��1024��5molCO2������ԭ�ӵ���ĿΪ10NA ��6.02��1024���𰸣�10NA ��6.02��1024��
6.02��1023mol-1=6.02��1024��5molCO2������ԭ�ӵ���ĿΪ10NA ��6.02��1024���𰸣�10NA ��6.02��1024��
(4)����Na2SO4![]() 2 Na+������0.25mol/L Na2SO4��Һ��Na+�����ʵ���Ũ����0.5mol/L ���𰸣�0.5��
2 Na+������0.25mol/L Na2SO4��Һ��Na+�����ʵ���Ũ����0.5mol/L ���𰸣�0.5��
(5)��Al3+�����ʵ���Ũ��Ϊx mol/L�����ݵ���غ���c(Mg2+)![]() 2+c(Al3+)��3= c(Cl��)����Ϊ��0.2
2+c(Al3+)��3= c(Cl��)����Ϊ��0.2![]() 2+3xmol/L=1.6mol/L ��x=0.4 ������Al3+�����ʵ���Ũ��Ϊ0.4mol/L���𰸣�0.4
2+3xmol/L=1.6mol/L ��x=0.4 ������Al3+�����ʵ���Ũ��Ϊ0.4mol/L���𰸣�0.4



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ���ʵ������в���ȷ����
A. �۲���ˮ����ɫ��������ˮ�ʻ���ɫ��˵����ˮ�д���Cl2
B. ����ˮ�е���̼������Һ�����������ɣ�˵����ˮ�д���H+
C. ����ˮ�еμ���������Һ���а�ɫ�������ɣ�˵����ˮ�д���Cl��
D. ��ˮ�����պ���ɫ����ʧ���ų����壬������Һ�����Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����д��ȷ���ǣ�������
A. ������������Fe3O4����������Fe3O4+8H+===Fe2+ + 2Fe3+ + 4H2O
B. Na2O2 ����H218O ��2Na2O2 + 2H2l8O ===4Na+ + 4OH-+ 18O2��
C. ˮ������ͨ�����������̼��Na2SiO3 +CO2 + H2O===2Na+ +CO32- + H2SiO3��
D. �ɷ�Ϊ����Ľ��������84������Һ���ʹ�����ж�:C1��+ C1O��+ 2H+=== Cl2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�����������ı仯�����й����е������仯�����ɻ�ѧ��Ӧ������ǣ� ��
A.��Ȼ��ȼ��
B.�кͷ�Ӧ
C.�����ڻ�
D.Ba��OH��28H2O������NH4Cl���巴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У��仯ѧ��������ȫ��ͬ���ǣ� ��
A.NH3��H2O
B.HCl��KCl
C.H2O��H2O2
D.NaCl��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±�ص�����������ȷ���ǣ� ��
A.±��ֻ�Ի���̬��������Ȼ����
B.��˵�������ӣ������۷е㽵��
C.��˵�������ӣ�������������ǿ
D.���ʾ������������ҷ�Ӧ����±����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��8�µ�eLife�Ϸ������ҹ�ҽѧ�����ߵ�һƪ���ġ�����ָ��С�մ������ư�֢�ķ����й�����û����ʵ��������ȡNaHCO3�ķ����ж��֡�
����һ��ģ�ҵ�������Ƽ����ȡ����ԭ��NaCl+H2O+CO2+NH3��NaHCO3��+NH4Cl��
��һ�������Ӻ�װ�ã����������ԣ���������װ��ҩƷ��
�ڶ�������ijһװ���ȷ�����Ӧ��ֱ�����������岻�����������ܽ⣬��ͨ����һװ���в��������壬Ƭ�̺����г��ֹ��塣����������ͨ���������壬ֱ�������й��������
�������������������õĻ����õ�NaHCO3���塣
���IJ�������Һ�м���������NaCl�����ĩ����NH4Cl����������
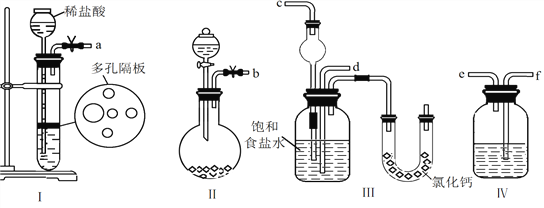 ��1��ͼ����ʾװ�õ�����˳���ǣ�a��f��e��________��b��________����ӿڱ�ţ���
��1��ͼ����ʾװ�õ�����˳���ǣ�a��f��e��________��b��________����ӿڱ�ţ���
��2������ʢ��ϡ���������������__________������Բ����ƿʢ���Լ�������__________������Ӧѡ�õ�Һ��Ϊ__________��ʵ���Ҽ��������������ķ���________________________��
��3���ڶ�������__________������ţ�װ���ȷ�����Ӧ��
��4�����IJ������õľ����г�����������NaCl��NaHCO3(Լռ5��~8��)�������һ������ʵ�飬��ʹ�������κ��Լ���֤�����þ������NH4C1����Ҫд������������_____________________________________��
����������CO2ͨ�뱥��Na2CO3��Һ��ȡNaHCO3��װ������ͼ��ʾ���������Ѽ��飬���ּг�װ���ԣ���
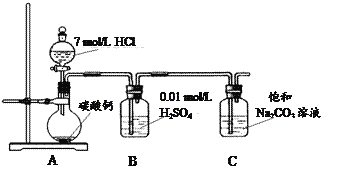
��5��װ��B������֮һ�����ջӷ�������HCl���壬��һ���ÿ���Ϊ___________________�����ϻ�ѧƽ���ƶ�ԭ�����ͣ�
��6��NaHCO3��Һ�к�̼����Ũ���ɴ�С����__________________________________
�����������Na2CO3��ҺҲ������NaHCO3��װ����ͼ��ʾ��
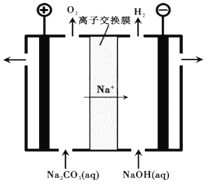
��7������������ҺNaHCO3���ɵ�ԭ����___________________________��
����ƷNaHCO3�г�����Na2CO3������NaHCO3�����ķ����ǣ�ȷ��ȡ��ƷWg��������ƿ�м�����ˮ�ܽ⣬��1~2�η�ָ̪ʾ������c mol/L�ı�������Һ�ζ�����Һ�ɺ�ɫ����ɫ��ָʾCO32��+H+=HCO3����Ӧ���յ㣩������������Һ���ΪV1mL���ټ�1~2�μ���ָʾ����������������Һ�ζ�����Һ�ɻƱ�ȣ�����������Һ���ΪV2mL��д����Ʒ��NaHCO3���������ļ���ʽ��______________��c��V1��V2��W��ʾ���������Ʊ�Һ���ᶨ��ʱ���ӿ̶��ߣ�����NaHCO3��������___________(�ƫ��ƫС�����䡱��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000mol/LNaOH��Һ�ֱ�ζ�20.00mL0.1000mol/LHCl��Һ��20.00mL0.1000mol/LCH3COOH��Һ���õ�2���ζ����ߣ�����ͼ��ʾ:
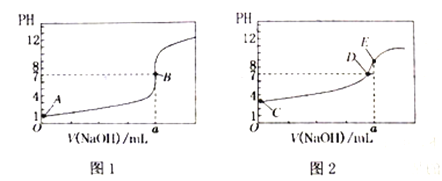
��1����A��C���жϣ��ζ�HCl��Һ��������__(����ͼ1������ͼ2��)��
��2��a=___mL��
��3��c(Na+)=c(CH3COO-)�ĵ���_______��
��4��E���Ӧ����Ũ���ɴ�С��˳��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����ˮ����ֳ�й㷺ʹ�õĹ�������
��1�����������Ʊ������ܶࡣ
���Ʊ�����һ��H2O2��Һ�������Ca(OH)2����Һ��Ӧ���Ʊ�CaO2��8H2O���仯ѧ����ʽΪ��____________________________________________________________��
���Ʊ������������÷�ӦCaC2+H2O2+2NH3��H2O+6H2O=CaO2��8H2O+2NH4Cl���ڼ��Ի�������ȡCaO2��NH3��H2O��Ca2+��H2O2�ķ�Ӧ�������������_____________________________________________���÷�Ӧ��Ҫ�ڱ�ˮԡ��������ɣ�ԭ��_____________________________________________��
���Ʊ������������÷�ӦCa(s)+O2 ![]() CaO2(s)���ڴ�����������ȡCaO2��ʵ����ģ��װ��ʾ��ͼ����
CaO2(s)���ڴ�����������ȡCaO2��ʵ����ģ��װ��ʾ��ͼ����
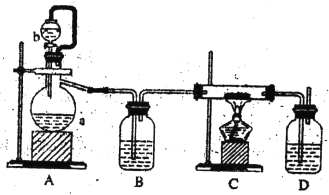
��ش���������
װ��A�з�Ӧ�Ļ�ѧ����ʽΪ______________________________��
����a������Ϊ_______________��װ��D��ʢ�е�Һ����Ũ���ᣬ������һ�ǹ۲����������٣��ж�����ͨ���Ƿ���켰������Ʒ�Ӧ���еij̶ȣ�����______________________________��
��2��ˮ��������(DO)�Ǻ���ˮ���Ծ�������һ��ָ�꣬ͨ����ÿ��ˮ���ܽ������ӵ�������ʾ����λmg��L-1���ⶨԭ��Ϊ��
���������£�O2��Mn2+����ΪMnO(OH)2��2Mn2++O2+40H��=2MnO(OH)2����
���������£�MnO(OH)2��I������ΪI2��MnO(OH)2+2I��+4H+=Mn2++I2+3H2O��
��Na2S2O3����Һ�ζ����ɵ�I2��2S2O32-+I2=S4O32-+2I��
ȡ�ӹ�һ��������CaQ2��8H2O�ij���ˮ��100.0mL�������������ⶨˮ��������������0.020mol��L-1Na2S2O3����Һ6.75mL���ζ�������ʹ�õ�ָʾ����_______________����ˮ���е��ܽ�������DO)Ϊ_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com