
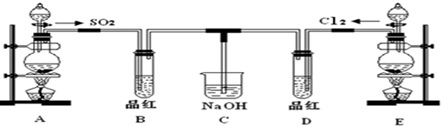
分析 A用于制备SO2,实验室用亚硫酸钠固体与硫酸反应制取SO2气体,该反应为Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,B用于检验二氧化硫的生成,E用浓盐酸和二氧化锰在加热条件下制备氯气,D用于检验气体的漂白性,C用于吸收尾气.
(1)氧化还原反应中失电子的元素化合价升高,元素被氧化,根据被氧化的盐酸和转移电子数之间的关系来计算;
(2)①氯水、二氧化硫都具有漂白性,都能够使品红褪色;
②氯水因含次氯酸,次氯酸具有氧化性,能漂白品红,但具有不可逆性,SO2的漂白具有可逆性;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性.
解答 解:(1)反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,氯从-1价变为0价,每生成1mol氯气,转移电子是2mol,即当2mol电子转移时,消耗盐酸是4mol,被氧化的HCl是2mol,所以若有0.2mol HCl被氧化,则转移的电子总数为0.2mol,即0.2NA,
故答案为:0.2NA;
(2)①氯气和二氧化硫都能是品红溶液褪色,所以B和D装置中品红都褪色,
故答案为:品红褪色、品红褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,
所以看到的现象是B中溶液由无色变为红色,D中无明显现象,
故答案为:由无色变为红色;无明显现象;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,生成物都无漂白性;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查物质的性质实验,侧重于学生的分析、实验能力的考查,题目涉及二氧化硫与氯气的制取以及二氧化硫漂白与次氯酸漂白的区别,题目难度中等,注意二者的性质的异同,特别是漂白原理的不同,本题易错点为(3).


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
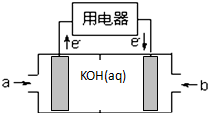 现有部分短周期元素的性质或原子结构如表:
现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 原子序数最小的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3 |
| D | 单质的一种同素异形体是保护地球地表环境的重要屏障 |
| E | 最高正化合价为+7 |
| F | 第3周期元素原子半径 最大 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
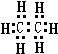 ,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.
,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(4) | B. | (2)(4) | C. | (4) | D. | (3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


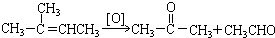
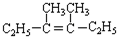 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 | |
| B. | 人们应用原电池原理,制成了多种电池,如干电池、充电电池、高能电池等.电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害,所以废旧电池必须回收再利用 | |
| C. | 明矾常用作净水剂,但人体摄入大量铝盐,易患老年性痴呆,所以明矾不宜大量作净水剂使用 | |
| D. | 氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的制冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品以减少氟氯烃的使用量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com