
【题目】下列说法正确的是( )
A.金属的晶胞如图所示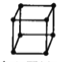 ,其配位数为8
,其配位数为8
B.![]() 分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为
分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为![]() 杂化,是直线型分子
杂化,是直线型分子
C.醋酸钠溶液中离子浓度的关系为:![]()
D.已知反应![]() ,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量
,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量![]() ,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:
,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:![]()
物质 |
|
|
|
浓度 |
|
|
|
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 向纯碱溶液中滴加醋酸,将生成的气体通入澄清的苯酚钠溶液中,观察是否出现沉淀,由此证明醋酸、碳酸、苯酚酸性强弱
C. 反应A(g)![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。
Ⅰ.某学习小组利用如下装置米探究FeSO4受热分解的产物。
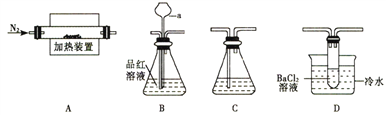
(1)甲组同学利用“A接B接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是____________________。
②仪器a的名称是_______________;其作用是____________________。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2外还有SO3;SO3的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的然,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3。
①装置D中的现象是_________________,BaCl2溶液不能用Ba(NO3)2溶液代替的原因是______________________。
②装置A中固体变为经红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式______________________。
③取硫酸亚铁样品18.20g,加热分解至恒重时测得固体质量为11.00g(假设杂质不反应),该硫酸亚铁样品的纯度为__________%(保留小数点后两位,下同),样品中铁元素的质量分数为_____________。
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:

已知:蓝色染料普鲁士蓝的合成方法如下:
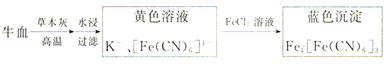
(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() 又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
Ⅰ.查阅材料
i.连二亚硫酸钠![]() 是一种白色粉末,易溶于水,难溶于乙醇。
是一种白色粉末,易溶于水,难溶于乙醇。
ii.![]()
iii.![]()
II.制备方法
![]() ℃时将甲酸钠和纯碱加入乙醇水溶液中,通入
℃时将甲酸钠和纯碱加入乙醇水溶液中,通入![]() 进行反应,完成其反应方程式:_____
进行反应,完成其反应方程式:_____![]() ______
______ ![]() ______ = ______
______ = ______ ![]() ______
______ ![]() ____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得
____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得![]() ;
;
III.![]() 的性质
的性质
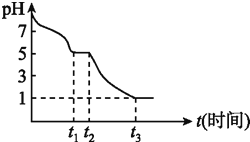
(1)![]() 溶液在空气中易被氧化,课题小组测定
溶液在空气中易被氧化,课题小组测定![]()
![]()
![]() 溶液在空气中pH变化如图:
溶液在空气中pH变化如图:![]() 段主要生成
段主要生成![]() ,根据pH变化图,
,根据pH变化图,![]() 的电离平衡 ______ 水解平衡
的电离平衡 ______ 水解平衡![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,课题小组推测
,课题小组推测![]() 溶液在空气中易被氧化,
溶液在空气中易被氧化,![]() 发生离子反应方程式为 ______
发生离子反应方程式为 ______ ![]() 时溶液中主要阴离子符号是 ______ 。
时溶液中主要阴离子符号是 ______ 。
(2)隔绝空气加热![]() 固体完全分解得到固体产物
固体完全分解得到固体产物![]() 、
、![]() 和气体为 ______
和气体为 ______ ![]() 填化学式
填化学式![]() 请你设计实验验证产物有
请你设计实验验证产物有![]() 存在,完成下表中内容.
存在,完成下表中内容.![]() 供选择的试剂:稀盐酸、稀硝酸、
供选择的试剂:稀盐酸、稀硝酸、![]() 溶液、
溶液、![]() 溶液
溶液![]()
实验步骤 | 预期的实验现象和结论 |
________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应类型中,不正确的是
A.![]() +HNO3
+HNO3![]() +H2O取代反应
+H2O取代反应
B.CH3CH3+Cl2![]() CH3CH2Cl+HCl置换反应
CH3CH2Cl+HCl置换反应
C.CH2=CH2+H2O![]() CH3CH2OH加成反应
CH3CH2OH加成反应
D.2CH3CHO+O2![]() 2CH3COOH氧化反应
2CH3COOH氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)标准状况下,22.4L Cl2的物质的量为________mol。
(2)实验室制取Cl2的化学方程式为 ________________________。
(3)收集Cl2应使用 _________ 法,要得到干燥的Cl2可选用 _______ 做干燥剂。
(4)写出实验室制取漂白液的反应的离子方程式 ______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH在一定温度和压强下于密闭容器中达到平衡。下列叙述正确的是( )
CO(g)+H2(g) ΔH在一定温度和压强下于密闭容器中达到平衡。下列叙述正确的是( )
A.升高温度,平衡常数K增大,则ΔH<0
B.缩小容器体积,c(CO)减小
C.恒压条件下,充入一定量的氮气,n(H2)增大
D.更换高效催化剂,H2O(g)的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)下列有关物质性质递变的描述中,正确的是________________(填代号)。
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=___________kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是____。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
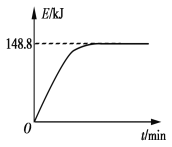
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为____________。
(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2![]() 2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,条件略去)。下列叙述不正确的是( )
A. 若a是铁,b是稀硝酸(过量),且a可溶于c溶液中。则a与b反应的离子方程式为 Fe+4H++NO3-=Fe3++NO↑+2H2O
B. 若c,d均为气体,且都能使澄清石灰水变浑浊,则将混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若c是无色刺激性气味的气体,其水溶液呈弱碱性。在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mo1-1的混合气体进行喷泉实验。假设溶质不扩散,试验完成后所得溶液的物质的量浓度约为0.056mo1·L-1
D. 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32+3HCO3-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com