
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
【答案】C
【解析】
试题①一个N≡N断裂的同时,有3个H—H键断裂,表示的都是正反应速率,无法判断正逆反应速率是否相等,①错误;②一个N≡N键断裂的同时,有6个N—H键断裂,正逆反应速率相等,达到了平衡状态,②正确;③反应两边气体的质量不变,气体的体积不相等,混合气体平均相对分子质量不再改变,说明正逆反应速率相等,达到了平衡状态,③正确;④保持其它条件不变时,体系压强不再改变,反应方程式两边气体的体积不相等,压强不变,说明正逆反应速率相等,达到了平衡状态,④正确;⑤NH3、N2、H2的体积分数都不再改变,说明各组分的浓度不变,达到了平衡状态,⑤正确;⑥恒温恒容时,混合气体的密度保持不变,由于气体的质量不变,容器的容积不变,所以气体的密度始终不变,故密度无法判断是否达到平衡状态,⑥错误;⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min),说明正逆反应速率相等,达到了平衡状态,⑦正确。故选C。


科目:高中化学 来源: 题型:
【题目】1-丁醇(液体)中溶有一种杂质,现利用下列方法提纯1-丁醇,路线如下:

已知1-丁醇、乙醚的部分性质如下表所示:
物质 | 沸点 | 密度 | 溶解性 |
1-丁醇 | 117.7℃ | 0.81g/cm3 | 能溶于水,易溶于乙醚 |
乙醚 | 34.6℃ | 0.71g/cm3 | 微溶于水 |
(1)加入饱和NaHSO3溶液的目的是______。
(2)操作Ⅱ的名称是______。
(3)萃取、分液所用的玻璃仪器的名称是______。为使1-丁醇尽可能多地从水中转移到乙醚中,萃取时向装有1-丁醇水溶液的仪器中加入一定量的乙醚,______、静置、分液,并重复多次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:______________________________。
(2)装置F的名称是___________________;装置C中的试剂是_____________;装置E中的h瓶需要冷却的理由是_____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”)。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
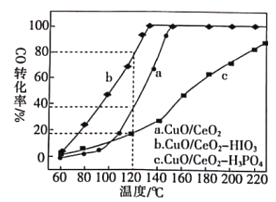
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
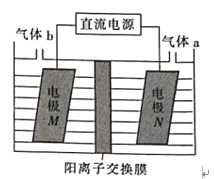
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请从下列化学方程式中选择正确答案,将其编号填入相应括号内。
a.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
b.2Fe+3Cl2![]() 2FeCl3
2FeCl3
c.NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
d.CaO+CO2=CaCO3
e.Cl2+H2O=HCl+HClO
(1)既是分解反应又是氧化还原反应的是(_________)
(2)是分解反应但不是氧化还原反应的是(_________)
(3)既是化合反应又是氧化还原反应的是(_________)
(4)是化合反应但不是氧化还原反应的是(_________)
(5)不属于四种基本反应类型的氧化还原反应的是(_________)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和 MnO2 制 Cl2,并以氯气为原料制备氯化铁,已知氯化铁容易与水发生水解反应,装 置如下图所示。

(1)装置 A 烧瓶中发生反应的化学方程式为:______________。
(2)装置 B、C 中应盛放的试剂名称分别为___________、________________若装置去掉 B、C,将对实验产生的安全隐患是_____________
(3)实验时,先点燃 A 处的酒精灯,让氯气充满装置,再点燃 D 处酒精灯,写出 D 中反应的化学方程式:_____。
(4)F 装置所起的作用是_____,_____。
(5)用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 32gO2所含的原子数目为NA
B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA
D. 0.5NA个CO2的物质的量是0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com