
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
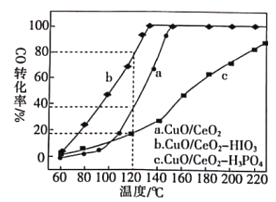
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
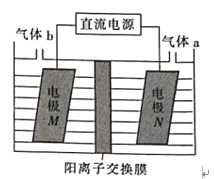
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
【答案】+131.45kJ/mol ![]() 0.0292molL-1min-1 Ce2(C2O4)3
0.0292molL-1min-1 Ce2(C2O4)3![]() 2CeO2+4CO↑+2CO2↑ 抑制 73.44 M极 2Cl- -2e-=Cl2↑ 5 Cl2+I2+6H2O=2HIO3+10HCl
2CeO2+4CO↑+2CO2↑ 抑制 73.44 M极 2Cl- -2e-=Cl2↑ 5 Cl2+I2+6H2O=2HIO3+10HCl
【解析】
(1)已知:①C(s)+![]() O2(g)═CO(g)△H1=-110.35kJmol-1
O2(g)═CO(g)△H1=-110.35kJmol-1
②2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJmol-1
③H2O(l)═H2O(g)△H3=+44.0kJmol-1
则:反应C(s)+H2O(g)═CO(g)+H2(g)可以是①+②×![]() -③得到,所以△H4=①+②×
-③得到,所以△H4=①+②×![]() -③=(-110.35kJmol-1)+(571.6kJmol-1)×
-③=(-110.35kJmol-1)+(571.6kJmol-1)×![]() -44.0kJmol-1=+131.45kJ/mol;
-44.0kJmol-1=+131.45kJ/mol;
反应C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数表达式为K=
CO(g)+H2(g)的平衡常数表达式为K=![]() ;
;
6min时生成0.7gH2,c(H2)=![]() ,根据反应C(s)+H2O(g)
,根据反应C(s)+H2O(g)![]() CO(g)+H2(g)可知,转化的c(CO)=c(H2),则6min内以CO表示的平均反应速率为υ(CO)=
CO(g)+H2(g)可知,转化的c(CO)=c(H2),则6min内以CO表示的平均反应速率为υ(CO)=![]() 0.0292molL-1min-1;
0.0292molL-1min-1;
(2)灼烧草酸铈[Ce(C2O4)3]分解制得CeO2、一氧化碳以及二氧化碳,反应方程式为:Ce2(C2O4)3![]() 2CeO2+4CO↑+2CO2↑;
2CeO2+4CO↑+2CO2↑;
相同时间内,CO的转化率越高,说明催化性能越好,由图象知道当H3PO4加入时,CO的转化率降低,则抑制CuO/CeO2的催化;
120℃时,CO的转化率是80%,气体混合物流速为1800mLmin-1;CO的体积分数为0.68%,则反应0.5小时后CO的体积为1800 mLmin-1×0.5h×60min/h×0.68%×(1-80%)=73.44mL;
(3)N极产生的气体a通入淀粉KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去,则气体a为Cl2,N极为阳极;则M是阴极,电极M上H+放电产生H2,促进M极附近水的电离,则LiOH在M极制得;N极为阳极,根据放电顺序,N极的电极反应式为2Cl- -2e-=Cl2↑;蓝色逐渐褪去是因为溶液中逐渐生成HIO3,说明Cl2将I2氧化成HIO3,则Cl2被还原成盐酸,反应的化学方程式为5Cl


科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是

A. 若该图表示的是活细胞的各化学元素的含量,则甲为碳元素
B. 若该图表示的是细胞各化学元素占干重的百分比,则甲为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向含有下列离子的溶液中加入少量SO3固体后,原溶液中离子的数目不变的是(提示:SO3+H2O=H2SO4)( )。
A.Mg2+B.![]() C.Ba2+D.OH-
C.Ba2+D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是 ( )
A. Mg2+、SO42-、OH-、K+B. Fe3+、NO3-、Cl-、H+
C. K+、HCO3-、Cl-、H+D. H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )

A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Fe属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:

下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com