
【题目】能在无色溶液中大量共存的一组离子是 ( )
A. Mg2+、SO42-、OH-、K+B. Fe3+、NO3-、Cl-、H+
C. K+、HCO3-、Cl-、H+D. H+、Na+、Cl-、SO42-
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。

如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是

A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。请回答下列问题:

(1)写出仪器A的名称______________;
(2)碎泡沫塑料的作用是__________________________;
(3)实验测得放出的热量为1.4kJ,写出其表示中和热的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
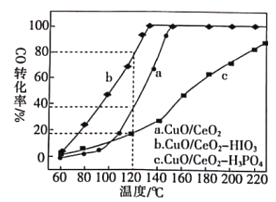
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
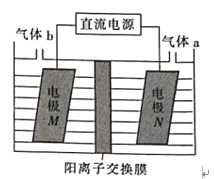
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: X(g)+2Y(g) ![]() 3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
A. 达到化学平衡状态时,Y 的正反应速率和 Z 的逆反应速率相等
B. 达到化学平衡状态时,X、Y、Z 的浓度之比为 1 : 2 : 3
C. 达到化学平衡状态时,反应放出的总热量一定小于 a kJ
D. 0.2 mol X 和 0.2 mol Y 充分反应生成 Z 的物质的量一定小于 0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
(2)CO2制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

①该反应化学平衡常数K的表达式是_________。
②0~9 min时间内,该反应的平均反应速率v(H2)=_________。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是_________(填字母序号)kJ。
a. 0<Q<29.5 b. 29.5<Q<36.75
c. 36.75<Q<49 d. 49<Q<98
④在一定条件下,体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

i. X表示的物理量是_________。
ii. 判断L1与L2的大小关系:L1________L2(填“<”,“=”或“>”),并简述理由:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜中一般含有锌、铁、银、金等杂质.在如图3所示装置中,甲池的总反应方程式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O 接通电路一段时间后,纯Cu电极质量增加了6.4 g。在此过程中,下列说法正确的是
A. 电子流向A→D→C→B
B. 乙池硫酸铜溶液的浓度不变
C. 甲池氧气消耗2.24 L
D. 甲池负极反应式为C2H5OH-12e﹣+16OH﹣=2CO32﹣+11H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com