
下列关于化学键的叙述正确的是
| A.离子化合物中只含离子键 | B.共价化合物一定不含离子键 |
| C.离子化合物一定不含共价键 | D.共价化合物可能含有离子键 |
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以Al(OH)3的形式存在 |
| C.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液,电池工作时溶液中的阴离子移向正极 |
| D.能通过化合反应制得FeCl2和Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
| A.①③⑤ | B.②④⑤ | C.②③④ | D.①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学键的说法正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.全部由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子中 |
| D.不同元素组成的多原子分子里的化学键一定都是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键。
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ,中心原子的杂化方式为 。
(3)反应物中电负性最大的元素为 (填元素符号),写出其原子最外层的电子排布图: 。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。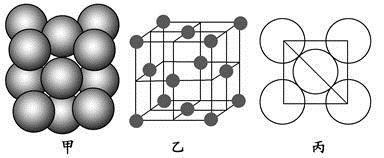
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为 ;Al晶体的密度为 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+
与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式 。
⑵NH2-的电子式为 。
⑶N3-有 个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式 、 。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
在下列各组气体中,试分析判断哪种气体更易液化?
①Cl2、N2;②SiH4、CH4;③SO2、CO2;④邻二甲苯、对二甲苯;⑤甲烷、乙烷;⑥丁烷、异丁烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com