
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+
与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式 。
⑵NH2-的电子式为 。
⑶N3-有 个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式 、 。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
⑴N2H62++2OH-=N2H4+2H2O ⑵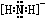 ⑶22
⑶22
⑷N2O CO2 CNO- BeF2 CaH2 C3H4等 ⑸直线型 ⑹一个单位正电荷
解析试题分析:⑴NH4+与碱反应的离子方程式为:NH4++OH-=NH3+H2O。由于NH4+与N2H62+结构相似,所以N2H62+在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O。⑵NH2-是NH3失去质子后形成的。所以NH2-的电子式为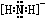 。⑶N是7号元素,所以N3-有22个电子。⑷由多个原子组成的含有与N3-电子数相同的物质有N2O 、 CO2、 CNO-、BeF2、CaH2、C3H4等。⑸等电子数的微粒往往具有相似的结构,由于CO2与N3—是等电子体。所以N3—的构型是直线型。⑹其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。其结构为
。⑶N是7号元素,所以N3-有22个电子。⑷由多个原子组成的含有与N3-电子数相同的物质有N2O 、 CO2、 CNO-、BeF2、CaH2、C3H4等。⑸等电子数的微粒往往具有相似的结构,由于CO2与N3—是等电子体。所以N3—的构型是直线型。⑹其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。其结构为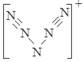 “N5”分子碎片所带电荷是一个单位正电荷。
“N5”分子碎片所带电荷是一个单位正电荷。
考点:考查氮元素形成的多种离子的结构与性质的知识。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:单选题
两个或多个同种含氧酸分子之间可以脱水形成相对分子质量更大的酸,如磷酸可形成H4P2O7或H5P3O10等。下列物质不属于硫酸脱水后形成的是( )
| A.H2S2O7 | B.H2S3O10 | C.H4S3O12 | D.H2S4O13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列7种固态物质:P4(白磷)、NH4Cl、Ca(OH)2、NaF、CO2、金刚石,回答下列问题(填写化学式或名称):[来源*:%z#zstep.^co&m]
①熔化时不需要破坏化学键的是___ _____,熔化时需要破坏共价键的是_____ ___;
②晶体中既有离子键又有共价键的是_____ ___。
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为_____ ___。
(2)某元素最高正化合价为+6,其最低负价为_____ ___。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为____ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ,它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ,Q与Y形成的分子的电子式是 ,属于 分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
| A.CO2 | B.H3O+ | C.CH4 | D.H2SO4 |
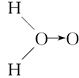 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。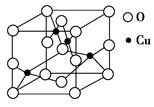
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下: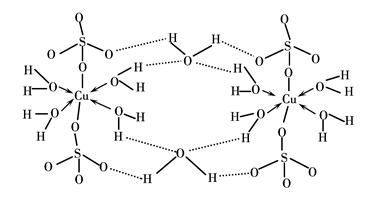
下列说法正确的是________(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。
(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com