
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大![]() 是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体
是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体![]() 请回答下列问题:
请回答下列问题:
(1)![]() 在元素周期表中的位置为______.
在元素周期表中的位置为______.
(2)![]() 、Q、M简单离子半径由大到小的顺序为
、Q、M简单离子半径由大到小的顺序为![]() 写元素离子符号
写元素离子符号![]() ______.
______.
(3)![]() 、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:
、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:![]() 用离子方程式表示
用离子方程式表示![]() ______
______![]() 溶液中所含离子浓度由大到小的顺序为______.
溶液中所含离子浓度由大到小的顺序为______.
(4)![]() 的电子式为______,
的电子式为______,![]() 与水可剧烈反应,产生沉淀与气体,反应的化学方程式为______.
与水可剧烈反应,产生沉淀与气体,反应的化学方程式为______.
(5)![]() 、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为______.
、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为______.
(6)![]() 的单质与R的最高价氧化物对应的水化物反应的离子方程式为______.
的单质与R的最高价氧化物对应的水化物反应的离子方程式为______.
【答案】 第三周期第IA族 Cl>O2>Mg2+ NH4++H2ONH3H2O+H+ c(NO3)>c(NH4+)>c(H+)>c(OH) 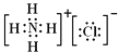 Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 共价键 Cl2+2OH=Cl+ClO+H2O
Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 共价键 Cl2+2OH=Cl+ClO+H2O
【解析】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大.X是原子半径最小的元素,故X为H元素;Y的气态氢化物能使湿润的红色石蕊试纸变蓝,故为氨气,则Y为N元素;Z为地壳中含量最多的元素,故为O元素;R与X同主族,且原子序数大于8,故R为Na元素;Y、R、Q最外层电子数之和为8,故Q的最外层有2个电子,且原子序数比11大,故为Mg元素;M的单质黄绿色有害气体,故为Cl元素。
(1)R为Na元素,在周期表中处于第三周期第IA族,故答案为:第三周期第IA族;
(2)Z、Q、M简单离子分别为O2、Mg2+、Cl,而微粒的电子层数越多,则半径越大,故Cl的半径最大;当电子层数相同时,核电荷数越多,则半径越小,故Mg2+的半径最小,故简单离子半径由大到小的顺序为Cl>O2>Mg2+,故答案为:Cl>O2>Mg2+;
(3)X、Y、Z三种元素形成盐类化合物为NH4NO3,NH4+水解显酸性:NH4++H2ONH3H2O+H+,由于NH4+水解,且溶液显酸性,故离子浓度大小为:c(NO3)>c(NH4+)>c(H+)>c(OH),故答案为:NH4++H2ONH3H2O+H+ ;c(NO3)>c(NH4+)>c(H+)>c(OH);
(4)YX4M为NH4Cl,为离子化合物,电子式为:![]() ;Q3Y2为Mg2N3,在水溶液中发生双水解生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;故答案为:
;Q3Y2为Mg2N3,在水溶液中发生双水解生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;故答案为:![]() ; Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
; Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(5)X、Z两元素形成的原子个数比为1:1的化合物为H2O2,为共价化合物,只含共价键,故答案为:共价键;
(6)M的单质即为氯气,与R的最高价氧化物对应的水化物即为NaOH反应,生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH=Cl+ClO+H2O,故答案为:Cl2+2OH=Cl+ClO+H2O


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是![]()
![]()
A. 浓硝酸在见光或受热时会发生分解 B. 久置的浓硝酸会变为稀硝酸
C. 金属与硝酸反应不产生氢气 D. 稀硝酸与铁反应而浓硝酸不与铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() ,还有少量的
,还有少量的![]() ,
,![]() 等杂质
等杂质![]() 提取氧化铝作冶炼铝的原料,提取的操作过程如下:
提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)![]() 和II步骤中分离溶液和沉淀的操作是: __________________;
和II步骤中分离溶液和沉淀的操作是: __________________;
(2)沉淀M中除含有泥沙外,一定还含有 ____________,固体N是 ____________;
(3)滤液X中,含铝元素的溶质的化学式为 ________________,它属于 _____![]() 填“酸”、“碱”或“盐”
填“酸”、“碱”或“盐”![]() 类物质;
类物质;
(4)实验室里常往![]() 溶液中加人 ________________
溶液中加人 ________________![]() 填“氨水”或“NaOH溶液”
填“氨水”或“NaOH溶液”![]() 来制取
来制取![]() ,请写出该反应的方程式 ___________________________
,请写出该反应的方程式 ___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列达到平衡状态的标志是( )
4NO(g)+6H2O(g),下列达到平衡状态的标志是( )
A. 达到化学平衡时5v正(NH3)=4v逆(O2)
B. 单位时间内生成4 mol NO的同时,消耗4 mol NH3
C. NH3、O2、NO、H2O的物质的量之比满足4∶5∶4∶6
D. 恒温恒容,气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A和2 mol B在2 L的容器中混合,并在一定条件下发生如下反应:2A(s)+B(g) ![]() 3C(g),若经2 s后测得C的浓度为0.6 mol·L-1,则
3C(g),若经2 s后测得C的浓度为0.6 mol·L-1,则
(1)用物质B表示的反应速率为_____。
(2)增加少量A,化学反应速率会____(增加、减小、不变);升高温度,化学反应速率会___(增加、减小、不变);要想减小反应速率,可以采取的措施有____(任填一项)。
(3)2s时物质B的浓度为____。
(4)对于该反应,说明反应达到化学平衡状态的有_____。
A.生成1molB,同时生成1molC B.3v(B)=v(C)
C.恒温恒容,压强不变时 D.气体的总质量不变时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数。B原子核内质子数和中子数相等。下列叙述不正确的是( )

A. C元素是非金属性最强的元素
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. 三种元素的原子半径的大小顺序是:B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )

A. Na+、Fe3+、K+、ClO—都可在该物质的溶液中大量共存
B. 该物质可以用于氧化还原滴定测定K2Cr2O7含量
C. 向0.1mol/L该物质的溶液中逐滴滴加0.1mol/LNaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如右图所示
D. 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42—完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是( )

A. 分解1molFe3O4转移电子数为2NA
B. 根据盖斯定律可知,△H1+△H2=0
C. FeO在CO2转化为C的过程中的作用是催化剂
D. 该工艺是将太阳能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com