
| A. | $\frac{(4b-2c)}{a}$ | B. | $\frac{(2b-c)}{a}$ | C. | $\frac{(4b-4c)}{a}$ | D. | $\frac{(2b-2c)}{a}$ |
分析 两等份溶液中一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+),另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-),再利用电荷守恒可知每份中2n(Mg2+)+n(Na+)=2n(SO42-),据此计算每份中n(Na+),最后根据c=$\frac{n}{V}$计算钠离子子的物质的量浓度.
解答 解:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol,
另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-)=$\frac{1}{2}$cmol,
由电荷守恒可知每份中满足:2n(Mg2+)+n(Na+)=2n(SO42-),则每份中溶液n(Na+)=2b-2×$\frac{1}{2}$cmol=(2b-c)mol,
则原混合溶液中钠离子的浓度为:c(Na+)=$\frac{(2b-c)mol}{\frac{1}{2}aL}$=$\frac{4b-2c}{a}$mol/L,
故选A.
点评 本题考查物质的量浓度的计算,为高频考点,题目难度不大,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | CO2的原子晶体和CO2的分子晶体具有相同的物理性质 | |
| C. | 对于CO2原子晶体,“CO2”是化学式,不是分子式 | |
| D. | CO2原子晶体在一定条件下转化为分子晶体的变化是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
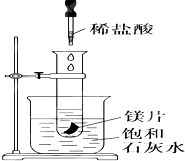 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中,丁元素的原子半径最小 | |
| B. | 气态氢化物的稳定性:乙>丙 | |
| C. | 同浓度的最高价含氧酸溶液的H+浓度丁>丙 | |
| D. | 元素甲和丙形成的两种常见化合物均为强还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,金属铝表面迅速氧化形成保护层 | |
| B. | 红热的铁丝与水接触,表面形成蓝黑色的保护层 | |
| C. | 常温下,浓硫酸使铝、铁等金属钝化 | |
| D. | 白铁(镀锌)表面有划伤时,仍然不易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| C. | 点燃的镁条插入盛有N2的集气瓶中,立即熄灭 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L溶液中K+浓度是0.4 mol•L-1 | |
| B. | 溶液中含有0.4NA个K+ | |
| C. | 1 L溶液中所含K+、SO42-总数为0.3NA | |
| D. | 2 L溶液中SO42-浓度是0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com