
| A. | 四种元素中,丁元素的原子半径最小 | |
| B. | 气态氢化物的稳定性:乙>丙 | |
| C. | 同浓度的最高价含氧酸溶液的H+浓度丁>丙 | |
| D. | 元素甲和丙形成的两种常见化合物均为强还原剂 |
分析 在短周期元素中,甲元素与乙、丙、丁三种元素紧密相邻(上下左右均可能),四种元素的最外层电子数之和为24,四种元素的最外层电子数平均为$\frac{24}{4}$=6,则甲、在短周期元素中,甲元素与乙、丙、丁三种元素紧密相邻(上下左右均可能),四种元素的最外层电子数之和为24,四种元素的最外层电子数平均为$\frac{24}{4}$=6,则甲、乙、丙、丁只能位于二、三周期;甲、乙两元素的原子序数之和比丙元素的原子序数多1,甲、乙、丙的位置关系为:① 或②
或②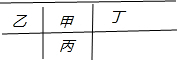 ,设甲的原子序数为x,①中乙、丙的原子序数分别为x+1、x+8,则x+x+1=x+8+1,解答x=8,则甲为O、乙为F、丙为S元素、丁为N元素;②中乙、丙的原子序数分别为x-1、x+8,则x+x-1=x+8+1,解答x=10,则甲为Ne,Ne位于周期表最右边,不存在丁,不满足条件;所以只有①符合,即甲、乙、丙、丁分别为O、F、S、N,据此结合元素周期律知识解答.
,设甲的原子序数为x,①中乙、丙的原子序数分别为x+1、x+8,则x+x+1=x+8+1,解答x=8,则甲为O、乙为F、丙为S元素、丁为N元素;②中乙、丙的原子序数分别为x-1、x+8,则x+x-1=x+8+1,解答x=10,则甲为Ne,Ne位于周期表最右边,不存在丁,不满足条件;所以只有①符合,即甲、乙、丙、丁分别为O、F、S、N,据此结合元素周期律知识解答.
解答 解:在短周期元素中,甲元素与乙、丙、丁三种元素紧密相邻(上下左右均可能),四种元素的最外层电子数之和为24,四种元素的最外层电子数平均为$\frac{24}{4}$=6,则甲、乙、丙、丁只能位于二、三周期;甲、乙两元素的原子序数之和比丙元素的原子序数多1,甲、乙、丙的位置关系为:① 或②
或② ,设甲的原子序数为x,①中乙、丙的原子序数分别为x+1、x+8,则x+x+1=x+8+1,解答x=8,则甲为O、乙为F、丙为S元素、丁为N元素;②中乙、丙的原子序数分别为x-1、x+8,则x+x-1=x+8+1,解答x=10,则甲为Ne,Ne位于周期表最右边,不存在丁,不满足条件;所以只有①符合,即甲、乙、丙、丁分别为O、F、S、N,
,设甲的原子序数为x,①中乙、丙的原子序数分别为x+1、x+8,则x+x+1=x+8+1,解答x=8,则甲为O、乙为F、丙为S元素、丁为N元素;②中乙、丙的原子序数分别为x-1、x+8,则x+x-1=x+8+1,解答x=10,则甲为Ne,Ne位于周期表最右边,不存在丁,不满足条件;所以只有①符合,即甲、乙、丙、丁分别为O、F、S、N,
A.同一周期中原子序数越大,原子半径越小,同一主族中,原子序数越大,原子半径越大,则原子半径最小的为乙(F),故A错误;
B.非金属性越强,气态氢化物稳定性越强,非金属性乙(F)大于丙(S),则气态氢化物的稳定性:乙>丙,故B正确;
C.丁、丙的最高价含氧酸分别为硝酸、硫酸,硝酸为一元强酸,硫酸为二元强酸,则同浓度的最高价含氧酸溶液的H+浓度丁<丙,故C错误;
D.甲为O、丙为S,二者形成的两种常见的化合物为二氧化硫、三氧化硫,二元化具有较强还原性,而三氧化硫为最高价氧化物,还原性非常弱,故D错误;
故选B.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 纸上层析法分为上升纸层析法和径向纸层析法 | |
| B. | 纸上层析法适用于分离和检验化学性质十分接近的分子或离子 | |
| C. | 它利用试样中的各种离子随展开剂在滤纸上展开的速率不同而达到分离目的 | |
| D. | 只有有色离子的检验才能用纸上层析法,否则无法看到色斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117a3ρ | B. | $\frac{M}{{{N_A}{a^3}}}$ | C. | $\frac{234}{{{a^3}ρ}}$ | D. | $\frac{58.5}{{2{a^3}ρ}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(4b-2c)}{a}$ | B. | $\frac{(2b-c)}{a}$ | C. | $\frac{(4b-4c)}{a}$ | D. | $\frac{(2b-2c)}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl2、NO3-、Fe2+ | B. | Fe3+、ClO-、Na+、SO32- | ||
| C. | CO32-、S2-、Na+、Ba2+ | D. | SO42-、Cl-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2g | B. | 5.4g | C. | 3.6g | D. | 2.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com