
| A. | 7.2g | B. | 5.4g | C. | 3.6g | D. | 2.7g |
分析 根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为甲:乙=3:4,由方程式2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知酸与金属反应时酸不过量,碱与金属反应时碱过量,结合方程式计算解答.
解答 解:根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为甲:乙=3:4,由方程式2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸与金属反应时酸不过量,碱与金属反应时碱过量,
盐酸和氢氧化钠溶液中溶质的物质的量均为:0.2L×3mol/L=0.6mol,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则:
2Al+6HCl═2AlCl3+3H2↑
6 3
0.6mol x
解得:x=$\frac{0.6mol×3}{6}$=0.3mol,
则碱与金属铝反应生成的氢气的物质的量为0.3mol×$\frac{4}{3}$=0.4mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.4mol
解得:y=$\frac{0.4mol×2}{3}$=$\frac{0.8}{3}$mol,
则铝的质量为$\frac{0.8}{3}$molmol×27g=7.2g,
故选A.
点评 本题考查化学反应方程式的计算,题目难度中等,判断反应中酸、碱是否足量为解答关键,试题有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 四种元素中,丁元素的原子半径最小 | |
| B. | 气态氢化物的稳定性:乙>丙 | |
| C. | 同浓度的最高价含氧酸溶液的H+浓度丁>丙 | |
| D. | 元素甲和丙形成的两种常见化合物均为强还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| C. | 点燃的镁条插入盛有N2的集气瓶中,立即熄灭 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
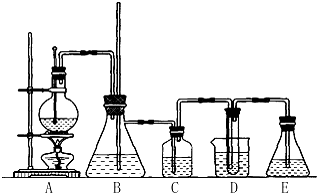
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a是一种非金属元素 | |
| B. | b与氧元素组成的氧化物一定是碱性氧化物 | |
| C. | c和d形成的化合物c2d2中各原子的最外层均达到8电子稳定结构 | |
| D. | b、c、d与氢元素形成的化合物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


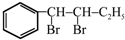



 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为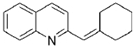 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com