
分析 除去食盐含Ca2+、Mg2+、SO42- 等杂质,可分别使离子生成沉淀而除去,一般情况下,有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,而Mg2+、SO42-除杂不分先后,则试剂加入顺序为NaOH-BaCl2-Na2CO3或BaCl2-NaOH-Na2CO3,
(4)①根据实验操作的步骤(计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签)以及每步操作需要仪器确定反应所需仪器分析;
②根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
③根据c=$\frac{n}{V}$计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高.
解答 解:(1)SO42-可用除去,生成硫酸钡沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,钙离子用碳酸根离子沉淀,离子方程式为Ca2++CO32-=CaCO3↓;镁离子用氢氧根离子沉淀,离子方程式为Mg2++2OH-=Mg(OH)2↓;
故答案为:Ba2++SO42-=BaSO4↓;Ca2++CO32-=CaCO3↓;Mg2++2OH-=Mg(OH)2↓;
(2)除去SO42-,必须添加钡试剂,但注意不能引入新杂质,可用Ba(OH)2、BaCl2,
故答案为:AC;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,而Mg2+、SO42-除杂不分先后,则试剂加入顺序为NaOH-BaCl2-Na2CO3或BaCl2-NaOH-Na2CO3,
故答案为:BC;
(4)①因配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:玻璃棒;100mL容量瓶;
②因Na2CO3的物质的量n=cV=0.1L×1.0mol•L-1=0.1mol,Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3•10H2O的质量0.1mol×286g/mol=28.6g,故答案为:28.6;
③A.往容量瓶转移时,有少量液体溅出,可导致浓度偏低,故A不选;
B.未洗涤溶解Na2CO3的烧杯,可导致浓度偏低,故B不选;
C.定容时俯视刻度线,体积偏小,浓度偏大,故C选;
D.容量瓶未干燥即用来配制溶液,对溶液的浓度没有影响,故D不选.
故答案为:C.
点评 本题考查物质分离提纯及除杂以及溶液的配制,为高频考点,把握除杂不能引入新的杂质及试剂的添加顺序为解答的关键,注意除杂试剂过量,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热是1 mol物质参加反应时的能量变化 | |
| B. | 当反应放热时△H>0,反应吸热时△H<0 | |
| C. | 任何条件下,化学反应的焓变都等于化学反应的反应热 | |
| D. | 在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓的差值来决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:1,1-二甲基乙醇 | B. | 有机物CH3CH=CHCH2OH的键线式为: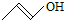 | ||
| C. | 乙醇分子的球棍模型: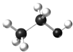 | D. | 氨基的电子式: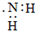 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用溴水或酸性KMnO4溶液都可鉴别乙烯和甲烷 | |
| B. | 在加热或加入重金属盐的情况下,蛋白质都可发生变性 | |
| C. | 液化石油气和天然气的主要成分都是甲烷 | |
| D. | 淀粉水解的最终产物是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
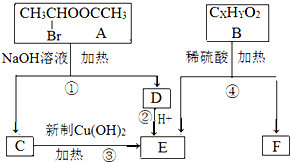 六种有机物之间的转化关系如图.已知:一个碳原子上连有两个羟基的结构极不稳定,易发生变化:R-CH(OH)2→RCHO+H2O
六种有机物之间的转化关系如图.已知:一个碳原子上连有两个羟基的结构极不稳定,易发生变化:R-CH(OH)2→RCHO+H2O
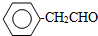 或
或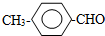 或(邻位、间位).
或(邻位、间位).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com