
 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.分析 (1)测定Na2CO3和NaCl混合物中Na2CO3含量,加入沉淀试剂氯化钙过量目的是完全沉淀碳酸根离子,证明氯化钙是否过量,可以取上层清液少许加入碳酸钠检验;确定沉淀是否完全的方法是,两次称量的质量相差不超过0.1g
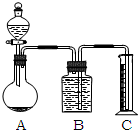
(2)依据装置图分析,气体法是利用加入的稀盐酸和碳酸钠反应生成二氧化碳气体,利用排液法测定二氧化碳的体积,为减小CO2的溶解,装置中B中的液体需要减小二氧化碳溶解,选择饱和碳酸氢钠溶液,即使通过饱和碳酸氢钠溶液,因为制备气体中含有HCl,和碳酸氢钠反应会生成二氧化碳,导致测定结果不准确;
(3)设计实验可以利用混合物中的氯化钠反应生成氯化银沉淀,测定氯化银的沉淀质量计算氯化钠质量得到样品中碳酸钠的质量分数.
解答 解:(1)沉淀法是利用碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,Na2CO3+CaCl2═CaCO3↓+2NaCl,称量沉淀质量,依据碳酸根离子物质的量为碳酸钠物质的量计算得到,把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、干燥、称量,加入沉淀试剂氯化钙过量目的是完全沉淀碳酸根离子,确定沉淀是否完全的方法是:确定CaCl2溶液是否过量,取少量的上层清液加入碳酸钠溶液,若变浑浊则CaCl2过量,沉淀完全,确定沉淀是否完全烘干的操作是:两次称量的质量相差不超过0.1g,
故答案为:洗涤、干燥、称量;取少量的上层清液加入碳酸钠溶液,若变浑浊则CaCl2过量,说明沉淀完全;两次称量的质量相差不超过0.1g;
(2)依据装置图分析,气体法是利用加入的稀盐酸和碳酸钠反应生成二氧化碳气体,利用排液法测定二氧化碳的体积,为减小CO2的溶解,装置中B中的液体需要减小二氧化碳溶解,选择饱和碳酸氢钠溶液,即使通过饱和碳酸氢钠溶液,因为制备气体中含有HCl,和碳酸氢钠反应会生成二氧化碳,导致测定结果不准确;
故答案为:NaHCO3溶液;因为从A制备出的气体中含有HCl,和碳酸氢钠反应会生成二氧化碳,导致测定结果不准确;
(3)可以利用混合物中的氯化钠反应生成氯化银沉淀,测定氯化银的沉淀质量计算氯化钠质量得到样品中碳酸钠的质量分数,把一定量的混合物溶解后加入足量的HNO3,再加AgNO3过滤洗涤烘干称量,用到试剂是HNO3和AgNO3;实验操作过程中需要用到反应后过滤得到沉淀继续称量,玻璃仪器有烧杯、玻璃棒、漏斗;
故答案为:把一定量的混合物溶解后加入足量的HNO3,再加AgNO3过滤洗涤烘干称量;HNO3和AgNO3;烧杯、玻璃棒、漏斗.
点评 本题考查了物质性质探究实验的方法和反应现象的分析判断,设计混合物中成分质量分数的实验,注意离子性质的应用,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | Al 和Mg | B. | K和 Na | C. | Na 和Al | D. | Zn 和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑤不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有①不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑧ | B. | ④⑤⑧ | C. | ③④⑤ | D. | ④⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com