
【题目】下列化学实验设计正确的是
A.稀![]() 与Cu反应产生的气体可用NaOH溶液完全吸收
与Cu反应产生的气体可用NaOH溶液完全吸收
B.将![]() 通人含有碳酸钙的水中制取较高浓度的次氯酸溶液
通人含有碳酸钙的水中制取较高浓度的次氯酸溶液
C.变色硅胶干燥剂含有![]() ,干燥剂呈蓝色时,表示不具有吸水干燥功能
,干燥剂呈蓝色时,表示不具有吸水干燥功能
D.探究![]() 浓度对化学反应速率的影响:取两只试管,分别加入
浓度对化学反应速率的影响:取两只试管,分别加入![]() 酸性溶液,然后向一只试管中加入
酸性溶液,然后向一只试管中加入![]() 溶液2mL,向另一只试管中加入
溶液2mL,向另一只试管中加入![]() 溶液4mL,比较两支试管褪色的时间
溶液4mL,比较两支试管褪色的时间
科目:高中化学 来源: 题型:
【题目】下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是
A.制备氢氧化铁胶体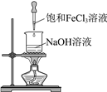 B.分离乙酸乙酯和饱和Na2CO3溶液
B.分离乙酸乙酯和饱和Na2CO3溶液
C.除去CO2中的少量HCl  D.收集NO2
D.收集NO2 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的2 L密闭容器中进行某一可逆反应:X(g)+2Y(g)![]() 2Z(g),用Y的物质的量浓度的改变表示反应速率v正、v逆与时间的关系如下图所示,已知单位为mol·L-1·s-1,则图中阴影部分的面积表示
2Z(g),用Y的物质的量浓度的改变表示反应速率v正、v逆与时间的关系如下图所示,已知单位为mol·L-1·s-1,则图中阴影部分的面积表示

A. X的物质的量浓度的减少值
B. Y的物质的量浓度的减少值
C. Z的物质的量的增加值
D. Y的物质的量的减少值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
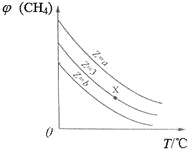
A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为我国电动汽车的新能源,其电极材料可表示为![]() ,且
,且![]() 。充电时电池总反应为:
。充电时电池总反应为:![]() ,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的
,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的

A.充电时,A为阴极,![]() 被氧化
被氧化
B.允许离子X通过的隔膜属于阴离子交换膜
C.可从无法充电的废旧电池的石墨电极中回收大量金属锂
D.放电时,正极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是“铁链状”图案,图中相连的两物质可归属于同一类别,相交部分A、B、C、D为其相应的分类依据代号。
![]()
(1)①写出相邻两种物质之间能发生反应的化学方程式______________________________
②写出除去NaCl溶液中杂质FeCl3的化学方程式__________________________。
(2)请简述选用图中物质制备Fe(OH)3胶体的实验操作_________________________。
(3)以下框图中化合物A是上述链状图中的一种物质,是生活中常见的一种调味品,如下图是该物质在化工生产中的一系列反应;其中化合物F俗称烧碱,单质C也是上述链状图中的一种物质。
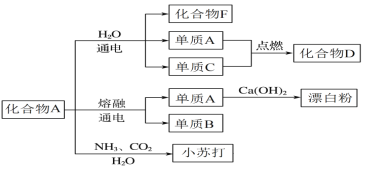
①写出单质B与H2O反应的离子方程式______________________________。
②单质A与Ca(OH)2反应制取漂白粉的化学方程式为 ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应4NH3+5O2=4NO+6H2O,回答下列问题:
(1)该反应中氧化剂是_______________,被氧化的是_________元素。
(2)该反应中氧化剂与还原剂的物质的量之比为______________。
(3)若反应中转移了10mol电子,则生成的NO在标准状况下的体积为_________。
(4)用单线桥法标出电子转移的方向与数目 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。

已知:
①氯气和碱反应放出热量。
②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
请回答下列问题。
(1)甲装置中仪器a的名称是___。
(2)圆底烧瓶内发生反应的化学方程式为___;装置乙中饱和食盐水的作用是___。
(3)装置丁中发生反应的离子方程式为___。
(4)漂白粉在空气中失效的原因是___、___(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2],其主要原因是___。
②为提高Ca(ClO)2的含量,可采取的措施是___(任写一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com