
【题目】三元电池成为我国电动汽车的新能源,其电极材料可表示为![]() ,且
,且![]() 。充电时电池总反应为:
。充电时电池总反应为:![]() ,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的
,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的

A.充电时,A为阴极,![]() 被氧化
被氧化
B.允许离子X通过的隔膜属于阴离子交换膜
C.可从无法充电的废旧电池的石墨电极中回收大量金属锂
D.放电时,正极反应式为:![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环境无污染。已知电池的总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A. 电池在放电时,Li+向电源负极移动
B. 充电时阳极的反应为LixV2O5-xe-===V2O5+xLi+
C. 放电时负极失重7.0 g,则转移2 mol电子
D. 该电池以Li、V2O5为电极,酸性溶液作介质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系错误的是( )
A.CH3CH2CH2CH2CH3和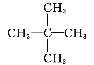 互为同分异构体
互为同分异构体
B.干冰和冰不是同一种物质
C.CH2 =CH2和CH2=CHCH3互为同系物
D.C4H10的一氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬绿的工艺流程如下:
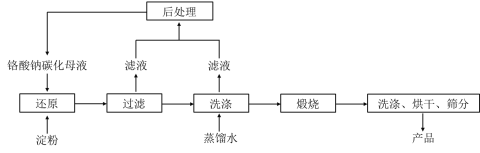
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式_________。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是_____(填标号)。
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_________。
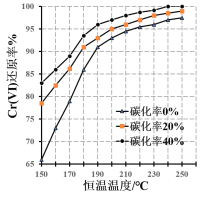
(4)滤液中所含溶质为_______。该水热法制备氧化铬绿工艺的优点有_________、________(请写出两条)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=_________。
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
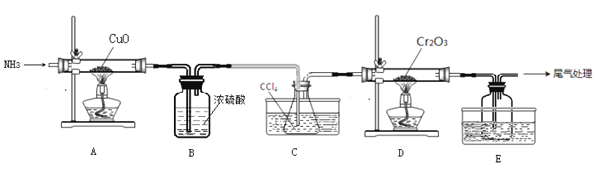
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物F和K是重要的药物合成中间体,可通过以下路线合成:
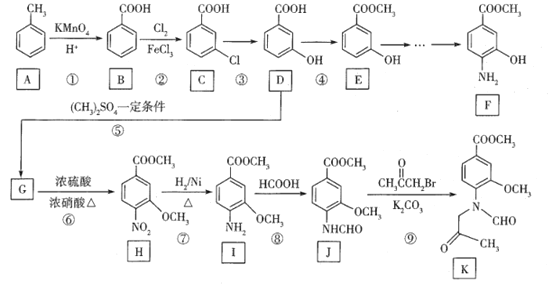
(1)C的化学名称为___________
(2)E中的官能团名称是__________。
(3)反应④所需的试剂和条件分别是___________、_____________。
(4)G的分子式为____________
(5)⑨的反应类型是_____________。
(6)写出符合下列条件的E的同分异构体的结构简式:_________(不考虑立体异构,只需写出3个)。
①能发生银镜反应;②遇FeCl3溶液发生显色反应;③核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1
(7)设计由![]() 和HO(CH2)5OH制备
和HO(CH2)5OH制备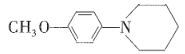 的合成路线:_______(无机试剂任选)。
的合成路线:_______(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com