
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬绿的工艺流程如下:
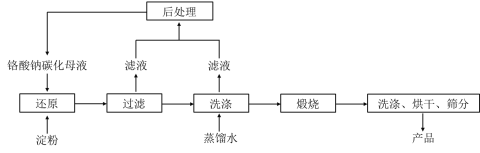
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式_________。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是_____(填标号)。
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
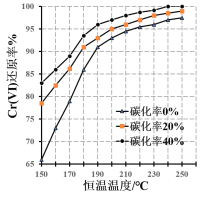
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_________。
(4)滤液中所含溶质为_______。该水热法制备氧化铬绿工艺的优点有_________、________(请写出两条)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=_________。
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为_________。
【答案】![]() AC 碳化率40%、恒温240℃ Na2CO3(或NaHCO3或Na2CO3、NaHCO3) 工艺清洁、原料价格低廉、设备要求低、副产物碳酸盐可用于铬酸钠碳化母液的制备 无废气废渣排放、废水可回收利用、流程短等 0.5
AC 碳化率40%、恒温240℃ Na2CO3(或NaHCO3或Na2CO3、NaHCO3) 工艺清洁、原料价格低廉、设备要求低、副产物碳酸盐可用于铬酸钠碳化母液的制备 无废气废渣排放、废水可回收利用、流程短等 0.5 ![]()
【解析】
在碱性条件下,利用铬酸钠碳化母液与淀粉发生氧化还原反应生成Cr(OH)3沉淀、碳酸钠或碳酸氢钠(取决于起始反应溶液的碱性),然后过滤、洗涤,通过煅烧Cr(OH)3然后经过一系列操作得到产品,以此解答。
(1)HCHO中碳元素化合价为0价,该反应在碱性环境下进行,最终生成为有碳酸钠、Cr(OH)3等,根据化合价升降守恒、电荷守恒以及原子守恒可知其反应的离子方程式为:![]() ;
;
(2)A.该反应虽然为放热反应,但不一定全过程都不需要加热,如燃烧反应为放热反应,反应开始需要加热,故A符合题意;
B.因该反应放热剧烈,若温度过高,Cr(OH)3可能会发生分解,会影响最终产品质量,因此可在必要时可使用冷却水进行温度控制,故B不符合题意;
C.为保证原料的充分利用,应淀粉适当过量,使铬酸钠充分反应,故C符合题意;
D.铬为重金属元素,直接排放至环境中会污染水资源,因此应建造废水回收池,回收含铬废水,故D不符合题意;
故答案为:AC;
(3)由图可知,在碳化率为40%时,还原率较高,在温度为240℃时,还原率达到接近100%,再升高温度对于还原率的影响不大,故最佳反应条件为:碳化率40%、恒温240℃;
(4)由上述分析可知,滤液中所含溶质为:Na2CO3(或NaHCO3或Na2CO3、NaHCO3);水热法制备工艺的优点有:工艺清洁、原料价格低廉、设备要求低、副产物碳酸盐可用于铬酸钠碳化母液的制备、无废气废渣排放、废水可回收利用、流程短等;
(5)加热过程中相关物质的转化关系式为:
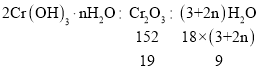
![]() ,解得n=0.5;
,解得n=0.5;
(6)重铬酸钠具有强氧化性,硫酸铵具有还原性,生产过程中产生的气体对环境无害,故N元素转化为N2,二者发生氧化还原反应生成Cr2O3、N2、Na2SO4、H2O,根据氧化和还原反应得失电子守恒和原子守恒可知该反应方程式为:![]() 。
。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
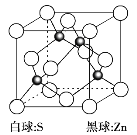
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO![]() -2e-=PbSO4,正极:PbO2+4H++SO
-2e-=PbSO4,正极:PbO2+4H++SO![]() +2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 molB.0.050 mol
C.0.10 molD.0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为我国电动汽车的新能源,其电极材料可表示为![]() ,且
,且![]() 。充电时电池总反应为:
。充电时电池总反应为:![]() ,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的
,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的

A.充电时,A为阴极,![]() 被氧化
被氧化
B.允许离子X通过的隔膜属于阴离子交换膜
C.可从无法充电的废旧电池的石墨电极中回收大量金属锂
D.放电时,正极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1molL-1NaOH溶液中加入0.1molL-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
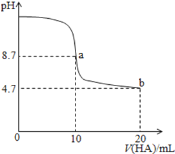
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. b点所示溶液中c(A-)>c(HA)
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. a、b两点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
(1)此时A的浓度为______;
(2)反应开始前放入容器中A、B的物质的量是_____________;
(3)B的平均反应速率是_________________;
(4)x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”);
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1________0 (填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择);
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________;
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
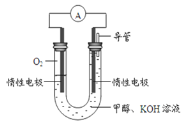
①该电池正极的电极反应为___________;
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3 时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6 的结构式为_____;(标出配位键)其中 Al 的配位数为_________。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____种。
(4)Co2+的价电子排布式_________。NH3 分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____(填“较大”,“较小”或“相同”),解释原因_____。
(5)已知 CrO5 中铬元素为最高价态,画出其结构式:_____。
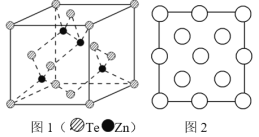
(6)阿伏加德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加德罗常数 NA=_____mol-1(列计算式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 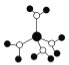 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. 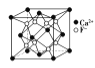 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com