
【题目】实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO![]() -2e-=PbSO4,正极:PbO2+4H++SO
-2e-=PbSO4,正极:PbO2+4H++SO![]() +2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 molB.0.050 mol
C.0.10 molD.0.20 mol
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
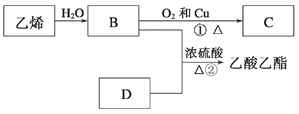
(1)乙烯的结构简式为___________。
(2)C中官能团的名称:__________ D中官能团的名称:__________。
(3)物质B可以被直接氧化为D,需要加入的试剂是_____。
(4)②的反应类型__________。
(5)写出①的化学方程式_________。写出②的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢型阳离子交换树脂(HR)可使水中的钙、镁离子通过离子交换而除去,羟型阴离子交换树脂(ROH)可以使氯离子等阴离子通过离子交换而除去,现代海水的一种淡化方法是使海水(含钙离子、镁离子、钠离子、氯离子等)依次通过两种离子交换树脂A、B (如图所示),
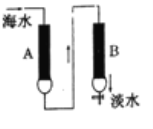
下列叙述中不正确的是( )
A.若两柱中均交换完全,从B处出来的淡水为中性
B.A柱为氢型离子交换树脂(HR), B柱为羟型离子交换树脂(ROH)
C.HR与钙离子的交换可表示为; 2HR+Ca2+=CaR2+2H+
D.两种交换树脂均可以持续使用,无需处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三颈烧瓶可用于苯的溴化实验,如图所示,苯和液溴加入装有铁粉的三颈烧瓶中。液体微沸。下列关于实验的操作或叙述不正确的是( )
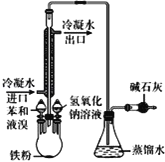
A.此反应不需要加热,为放热反应
B.冷凝管只有冷凝、回流的作用
C.连接好仪器,检查装置气密性,再加入相应试剂制取溴苯
D.NaOH的作用为除杂、提纯等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬绿的工艺流程如下:
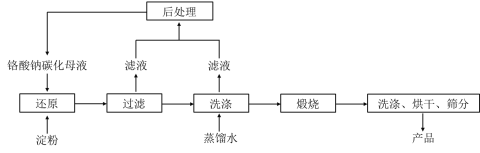
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式_________。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是_____(填标号)。
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_________。
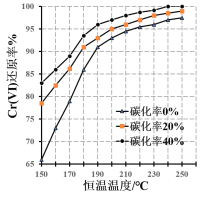
(4)滤液中所含溶质为_______。该水热法制备氧化铬绿工艺的优点有_________、________(请写出两条)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=_________。
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将ag NH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为bmoL。下列叙述中不正确的是( )
A. 溶质的质量分数为ω=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]()
C. 溶液中c(OH-)=![]() +c(H+)
+c(H+)
D. 上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com