
【题目】已知乙烯能发生以下转化:
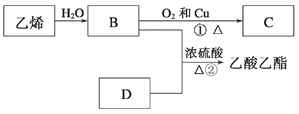
(1)乙烯的结构简式为___________。
(2)C中官能团的名称:__________ D中官能团的名称:__________。
(3)物质B可以被直接氧化为D,需要加入的试剂是_____。
(4)②的反应类型__________。
(5)写出①的化学方程式_________。写出②的化学方程式________。
【答案】CH2=CH2 醛基 羧基 酸性KMnO4溶液或酸性K2Cr2O7溶液 酯化反应(或取代反应) 2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O CH3CH2COOH+CH3CH2OH
2CH3CHO+2H2O CH3CH2COOH+CH3CH2OH![]() CH3CH2COOC2H5+H2O
CH3CH2COOC2H5+H2O
【解析】
乙烯在催化剂作用下与水发生加成反应生成B为乙醇,乙醇在铜的催化下与氧气发生氧化反应生成C为乙醛,乙醇与乙酸在浓硫酸催化下发生酯化反应生成乙酸乙酯,故D为乙酸,据此分析解答。
乙烯在催化剂作用下与水发生加成反应生成B为乙醇,乙醇在铜的催化下与氧气发生氧化反应生成C为乙醛,乙醇与乙酸在浓硫酸催化下发生酯化反应生成乙酸乙酯,故D为乙酸。
(1)乙烯的结构简式为CH2=CH2;
(2)C为乙醛,官能团的名称为醛基;D为乙酸,官能团的名称为羧基;
(3)物质B乙醇可以被直接被酸性KMnO4溶液或酸性K2Cr2O7溶液氧化为D乙酸,故需要加入的试剂是KMnO4溶液或酸性K2Cr2O7溶液;
(4)②是乙醇和乙酸在浓硫酸催化下发生酯化反应,也属于取代反应生成乙酸乙酯,反应类型为酯化反应(或取代反应);
(5)反应①是乙醇在铜的催化下与氧气发生氧化反应生成乙醛和水,反应的化学方程式为2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;反应②是乙醇与乙酸在浓硫酸催化下发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3CH2COOH+CH3CH2OH
2CH3CHO+2H2O;反应②是乙醇与乙酸在浓硫酸催化下发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3CH2COOH+CH3CH2OH![]() CH3CH2COOC2H5+H2O。
CH3CH2COOC2H5+H2O。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是

①1 mol阿昔洛韦在催化剂作用下,最多可与5molH2发生加成反应;②属于芳香烃;③是一种易溶于水的醇;④可以被催化氧化;⑤不能使溴水褪色;⑥可以燃烧;
A. ①②③④⑥B. ②④⑤⑥C. ③④⑤⑥D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________。
③FeCl3净水的原理是:___________________________(用离子方程式及适当文字回答);
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。

①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择__________(填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________(填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为__________。
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式 __________________________
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻羟基苯甲酸(俗名水杨酸)其结构简式为如图所示:

(1)水杨酸既可以看成是_______类物质,同时也可以看成_____类物质。
(2)将其与_______溶液作用生成物的化学式为C7H5O3Na,将其与______溶液作用生成物的化学式为C7H4O3Na2。
(3)水杨酸的不同类同分异构体中,属于酚类且也具有苯环的化合物的结构简式为_______,它还可看成是______类物质。
(4)比水杨酸多一个CH2原子团,且与水杨酸属于同系物的取代基数目不同的物质的结构简式为___。
(5)比水杨酸多一个CH2原子团,且与水杨酸不属于同系物的物质的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以AgZSM为催化剂,在容积为1L的容器中,相同时间下测得0.1molNO转化为N2的转化率随温度变化如图所示[无CO时反应为2NO(g)![]() N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)
N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)]。下列说法正确的是( )
2CO2(g)+N2(g)]。下列说法正确的是( )
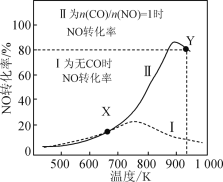
A.反应2NO(g) ![]() N2(g)+O2(g)的ΔH>0
N2(g)+O2(g)的ΔH>0
B.达平衡后,其他条件不变,使![]() >1,CO转化率上升
>1,CO转化率上升
C.X点可以通过更换高效催化剂提高NO转化率
D.Y点再通入CO、N2各0.01mol,此时v(CO,正)<v(CO,逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
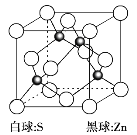
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO![]() -2e-=PbSO4,正极:PbO2+4H++SO
-2e-=PbSO4,正极:PbO2+4H++SO![]() +2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-=PbSO4+2H2O。今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 molB.0.050 mol
C.0.10 molD.0.20 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com