
【题目】已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为__________。
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式 __________________________
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
【答案】Mg2C3+4H2O=2 Mg(OH)2+C3H4↑ 2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑ NaOCN、NaCN 29800
【解析】
(1)该烃分子中碳氢质量比为9:1,C、H的物质的量之比为![]() :
:![]() =3:4,根据“碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃”可知该烃的化学式为C3H4;Q的化学式为Mg2C3,Mg2C3与水反应生成氢氧化镁和C3H4,反应的化学方程式为:Mg2C3+4H2O=2Mg(OH)2+C3H4↑;
=3:4,根据“碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃”可知该烃的化学式为C3H4;Q的化学式为Mg2C3,Mg2C3与水反应生成氢氧化镁和C3H4,反应的化学方程式为:Mg2C3+4H2O=2Mg(OH)2+C3H4↑;
(2)①反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;
②(CN)2与Cl2的化学性质相似,根据氯气与氢氧化钠溶液反应的原理可知,(CN)2与NaOH溶液反应生成NaOCN、NaCN、和H2O,故答案为:NaOCN;NaCN;
③参加反应的NaCN是:![]() =40mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:
=40mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:![]() ×74.5g/mol×4=29800g。
×74.5g/mol×4=29800g。


科目:高中化学 来源: 题型:
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
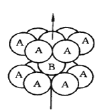
(1)基态钛原子的价层电子排布图为__________,其原子核外共有______种空间运动状态不同的电子,金属钛的堆积方式如图所示,为________(填堆积方式)堆积
(2)①已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,均高于结构与其相似的CCl4,主要原因是_______。
②TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有______。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.金属键
(3)硫酸氧钛晶体中阳离子为链状聚合形式,结构如图所示,其中Ti-O-Ti在一条直线上。该阳离子化学式为__________,其中O原子的杂化方式为_______。
![]()
(4)2016年7月,研究人员发现了某种钛金合金的化学式是Ti3Au,它具有生物相容性,是理想的人工髋关节和膝关节;其晶胞结构如图所示,晶胞参数为a pm,最近的Ti原子距离为![]() ,A原子的坐标参数为(
,A原子的坐标参数为(![]() ,
,![]() ,
,![]() ),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm
),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 0.5mol雄黄(As4S4),结构如右图,含有NA个S-S键![]()
B. 将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C. 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D. 高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
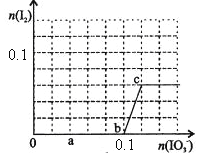
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B. CH2===CH2+HCl―→CH3CH2Cl
C. CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
D. 2CH3CH3+7O2![]() 4CO2+6H2O
4CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
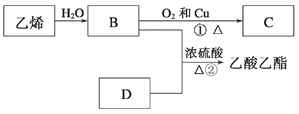
(1)乙烯的结构简式为___________。
(2)C中官能团的名称:__________ D中官能团的名称:__________。
(3)物质B可以被直接氧化为D,需要加入的试剂是_____。
(4)②的反应类型__________。
(5)写出①的化学方程式_________。写出②的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环境无污染。已知电池的总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A. 电池在放电时,Li+向电源负极移动
B. 充电时阳极的反应为LixV2O5-xe-===V2O5+xLi+
C. 放电时负极失重7.0 g,则转移2 mol电子
D. 该电池以Li、V2O5为电极,酸性溶液作介质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com