
【题目】下列反应中属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B. CH2===CH2+HCl―→CH3CH2Cl
C. CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
D. 2CH3CH3+7O2![]() 4CO2+6H2O
4CO2+6H2O
 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们对应的信息如下:
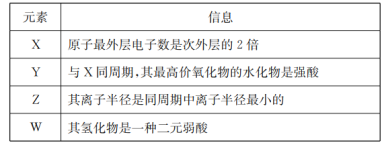
请根据表中信息填写:
(1)Z元素在周期表中的位置___________,Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于___________(填“吸热”或“放热”)反应。
(2)XW2的电子式____________。
(3)由X、Y、W三种元素按原子个数之比1:1:1组成一种分子,相对分子质量为116。已知该分子中各原子均达到8电子稳定结构,且不含双键。请写出该分子的结构式________。
(4)X、Y的最简单氢化物中,更稳定的是___________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷与苯的反应如图所示(无机小分子产物略去)。下列说法正确的是
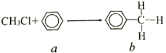
A.该反应属于化合反应
B.a与溴水在铁作催化剂条件下反应生成溴苯
C.b中最多有14个原子共平面
D.b的二氯代物有10种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为__________。
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式 __________________________
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
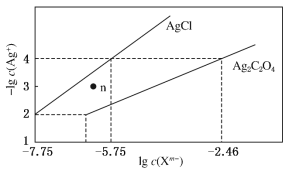
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com