
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铊(Tl)是某超导材料的组成元素之一,与铝同族,位于周期表第六周期。Tl3+与银在酸性溶液中发生反应:Tl3++2Ag![]() Tl++2Ag+,下列推断正确的是( )
Tl++2Ag+,下列推断正确的是( )
A.Tl+的最外层有1个电子B.Tl能形成+3价和+1价的化合物
C.Tl3+氧化性比铝离子弱D.Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液+1 mL H2O | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+1 mL HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+1 mL NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是____。
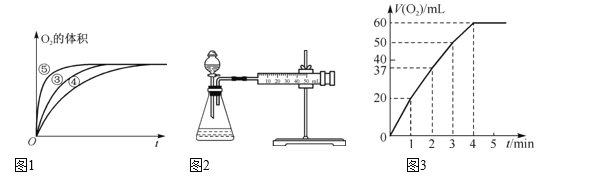
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2状态 | 触摸试管情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 4 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:__,该反应是____反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:__,计算H2O2的初始物质的量浓度为____。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(CN)2的氧化性比Br2弱而比I2强,NaCN的水溶液呈碱性,则下列有关变化一般不能发生的是
A. CH2=CH2+(CN)2→NC-CH2-CH2-CN
B. (CN)2+2Br-→2CN-+Br2
C. (CN)2+2OH-→CN-+CNO-+H2O
D. HCN![]() H++CN-
H++CN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常见元素及化合物的转化关系如图所示:
![]()
又知A~E中均含有一种相同元素。下列说法错误的是( )
A.物质A一定是单质B.物质C可能是淡黄色固体
C.物质D可能是酸或碱D.物质E可能属于盐类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂作用下,氮氧化物与一氧化碳能发生反应,如:
![]()
![]()
![]() 反应Ⅰ
反应Ⅰ
(1)已知:![]()
![]() 反应Ⅱ
反应Ⅱ
![]()
![]() 反应Ⅲ
反应Ⅲ
①![]() __________(用含b、c的代数式表示)。
__________(用含b、c的代数式表示)。
②温度为![]() 时,CO与
时,CO与![]() 在密闭容器中发生反应Ⅲ,
在密闭容器中发生反应Ⅲ,![]() 的体积分数
的体积分数![]() 随时间变化的关系如下图所示。请在坐标图中画出温度为
随时间变化的关系如下图所示。请在坐标图中画出温度为![]() 时,
时,![]() 随时间的变化曲线并进行相应的标注。_______
随时间的变化曲线并进行相应的标注。_______
(2)在恒压条件下,将NO和CO置于密闭容器中发生反应Ⅰ,在不同温度、不同投料比![]() 时,NO的平衡转化率见下表:
时,NO的平衡转化率见下表:
| 300K | 400K | 500K |
1 | 15% | 24% | 33% |
2 | 10% | 18% | 25% |
a__________(填“>”“<”或“=”)0,理由是_________。试判断反应Ⅰ在常温下能否自发进行并说明理由:___。
②下列措施有利于提高CO平衡转化率的是__________(填字母)。
A.升高温度同时增大压强
B.继续通入CO
C.加入高效催化剂
D.及时将![]() 从反应体系中移走
从反应体系中移走
③500 K时,将投料比为2的NO与CO混合气体共0.9 mol,充入一装有催化剂且体积为3 L的密闭容器中,5 min时反应达到平衡,则500 K时该反应的平衡常数K为__________(保留两位小数,下同);从反应开始到达到平衡时CO的平均反应速率为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应H2(g) + I2(g) ![]() 2HI(g) 达到平衡状态的标志是
2HI(g) 达到平衡状态的标志是
A.单位时间消耗n mol H2,同时生成2n mol HIB.体系的颜色不再变化
C.H2的体积分数保持不变D.H2、 I2、HI 的分子数之比为 1 ∶1∶ 2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com