
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
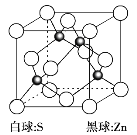
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
【答案】![]() Zn失去第二个电子达到3d10稳定结构,而Cu失去第一个电子即达到稳定结构 短 氧原子半径小于硫,水分子中成键电子对之间排斥力大于H2S(或从电负性角度分析,合理即可) V 形
Zn失去第二个电子达到3d10稳定结构,而Cu失去第一个电子即达到稳定结构 短 氧原子半径小于硫,水分子中成键电子对之间排斥力大于H2S(或从电负性角度分析,合理即可) V 形 ![]() 吡咯分子间存在氢键,噻吩分子间没有氢键 6
吡咯分子间存在氢键,噻吩分子间没有氢键 6 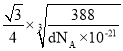
【解析】
(1)(2)主要考查核外电子排布规律, 元素的电离能主要与原子的核外电子排布有关系;
(3)考查分子的键长、键角。键长主要与成键原子的半径有关系,原子半径越大,键长越长;键角主要与电子对的斥力有关系,在同构型的分子中,还要考虑成键电子对及中心原子半径的影响;
(4)![]() 的空间构型,可先从电子式入手,写出正确的电子式,再结合中间S原子的孤电子对,可以推出它的空间构型为V型;
的空间构型,可先从电子式入手,写出正确的电子式,再结合中间S原子的孤电子对,可以推出它的空间构型为V型;
(5)①题中已经告知大π键的写法,据此答题即可;
②吡咯分子中含有N原子,其沸点比噻吩分子高,一定是受氢键的影响;
(6)本题主要考查晶胞结构的计算,需要注意题目的问法。
(1)S原子的价电子排布式为3s23p4,则其价电子的排布图为![]() ;(2)Cu的核外电子排布为1s22s22p63s23p63d104s1,Zn的核外电子排布为1s22s22p63s23p63d104s2,Zn 失去第二个电子达到 3d10 稳定结构,而 Cu 失去第一个电子即达到稳定结构,所以I2(Cu)>I2(Zn);
;(2)Cu的核外电子排布为1s22s22p63s23p63d104s1,Zn的核外电子排布为1s22s22p63s23p63d104s2,Zn 失去第二个电子达到 3d10 稳定结构,而 Cu 失去第一个电子即达到稳定结构,所以I2(Cu)>I2(Zn);
(3)H2O分子中的键长比H2S中的键长短,因为O的原子半径比S的小;氧原子半径小于硫,水分子中成键电子对之间排斥力大于 H2S;
(4)![]() 的电子式为:
的电子式为:![]() ,由于中心S原子含有两对孤电子,所以该离子的空间构型为V形;
,由于中心S原子含有两对孤电子,所以该离子的空间构型为V形;
(5)①噻吩分子的大π键由5个原子构成,参与形成大π键的电子数有6个,故噻吩的大π键可表示为![]() ;
;
②吡咯含有N原子,故其分子间存在氢键,噻吩分子间没有氢键,所以吡咯的沸点高一些;1mol吡咯,含有1mol N-H键,2mol N-C键,1mol C-C键,2mol C=C键,所以1mol吡咯含有6mol σ键;
(6)该晶胞中,S2-有![]() =4个,Zn2+有1×4个,则该晶胞含有4个ZnS,设晶胞的棱长为a nm,则有
=4个,Zn2+有1×4个,则该晶胞含有4个ZnS,设晶胞的棱长为a nm,则有 ,解得a=
,解得a=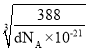 nm,由于1个Zn2+周围有4个S2-,且形成了边长为
nm,由于1个Zn2+周围有4个S2-,且形成了边长为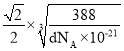 nm的正四面体,所以Zn2+与S2-的最短核间距为:
nm的正四面体,所以Zn2+与S2-的最短核间距为: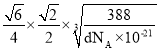 =
=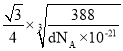 nm
nm


科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
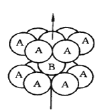
(1)基态钛原子的价层电子排布图为__________,其原子核外共有______种空间运动状态不同的电子,金属钛的堆积方式如图所示,为________(填堆积方式)堆积
(2)①已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,均高于结构与其相似的CCl4,主要原因是_______。
②TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有______。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.金属键
(3)硫酸氧钛晶体中阳离子为链状聚合形式,结构如图所示,其中Ti-O-Ti在一条直线上。该阳离子化学式为__________,其中O原子的杂化方式为_______。
![]()
(4)2016年7月,研究人员发现了某种钛金合金的化学式是Ti3Au,它具有生物相容性,是理想的人工髋关节和膝关节;其晶胞结构如图所示,晶胞参数为a pm,最近的Ti原子距离为![]() ,A原子的坐标参数为(
,A原子的坐标参数为(![]() ,
,![]() ,
,![]() ),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm
),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
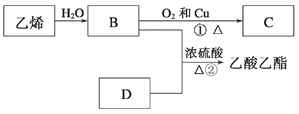
(1)乙烯的结构简式为___________。
(2)C中官能团的名称:__________ D中官能团的名称:__________。
(3)物质B可以被直接氧化为D,需要加入的试剂是_____。
(4)②的反应类型__________。
(5)写出①的化学方程式_________。写出②的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环境无污染。已知电池的总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A. 电池在放电时,Li+向电源负极移动
B. 充电时阳极的反应为LixV2O5-xe-===V2O5+xLi+
C. 放电时负极失重7.0 g,则转移2 mol电子
D. 该电池以Li、V2O5为电极,酸性溶液作介质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可降解聚合物 P 的合成路线如图:
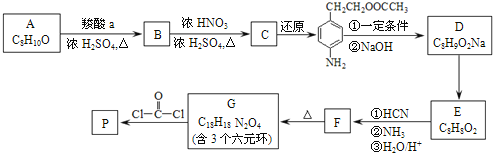
已知: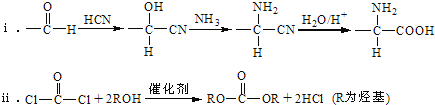 .
.
(1)A的含氧官能团名称是______。
(2)羧酸a的电离方程式是______。
(3)B→C的化学方程式是______。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是______。
(5)E→F中反应①和②的反应类型分别是______、______。
(6)F的结构简式是______。
(7)G→聚合物P的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
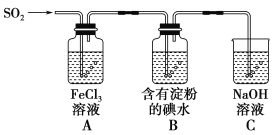
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢型阳离子交换树脂(HR)可使水中的钙、镁离子通过离子交换而除去,羟型阴离子交换树脂(ROH)可以使氯离子等阴离子通过离子交换而除去,现代海水的一种淡化方法是使海水(含钙离子、镁离子、钠离子、氯离子等)依次通过两种离子交换树脂A、B (如图所示),
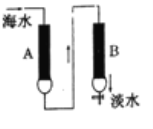
下列叙述中不正确的是( )
A.若两柱中均交换完全,从B处出来的淡水为中性
B.A柱为氢型离子交换树脂(HR), B柱为羟型离子交换树脂(ROH)
C.HR与钙离子的交换可表示为; 2HR+Ca2+=CaR2+2H+
D.两种交换树脂均可以持续使用,无需处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬绿的工艺流程如下:
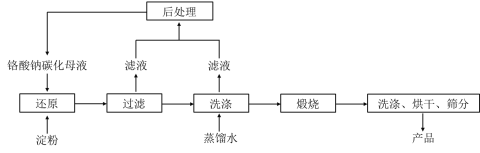
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式_________。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是_____(填标号)。
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
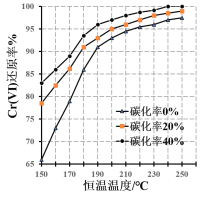
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_________。
(4)滤液中所含溶质为_______。该水热法制备氧化铬绿工艺的优点有_________、________(请写出两条)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=_________。
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com