
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
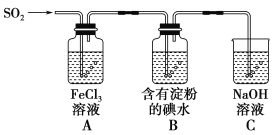
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
【答案】SO42- Fe2+ BD 吸收多余的二氧化硫,防止污染空气 SO2 + I2 +2H2O = 4H+ +SO42- +2I- ① SO2也能使酸性高锰酸钾溶液褪色
【解析】
二氧化硫与碘、Fe3+发生氧化还原反应,方程式分别为SO2+I2+2H2O=H2SO4+2HI,2Fe3++SO2+2H2O =2Fe2++SO42-+4H+,由于二氧化硫具有毒性,所以用氢氧化钠溶液进行尾气处理。实验室制备气体要求操作简便安全,产物单一或易于提纯。
(1)根据氧化还原反应原理,二氧化硫中的硫元素化合价升高,失去电子,发生氧化反应,故SO2气体和Fe3+反应的氧化产物是SO42-,F e3+被还原为Fe2+,还原产物是Fe2+;
(2)A.Na2SO3具有还原性,硝酸具有氧化性,Na2SO3与HNO3反应生成Na2SO4、NO和水,不能制备SO2;
B.Na2SO3固体与浓硫酸,利用浓硫酸的酸性,强酸制弱酸Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,产物单一,符合题意;
C.固体硫在纯氧中燃烧,产生二氧化硫,但是纯氧量无法控制,不用于实验室制备SO2;
D.铜与浓H2SO4共热,实验室制取二氧化硫的常用反应,Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,产物单一,符合题意。
CuSO4+SO2↑+2H2O,产物单一,符合题意。
综上所述,采用BD进行SO2的实验室制备。
(3)二氧化硫具有毒性,氢氧化钠与SO2发生反应,保护环境。装置C的作用是吸收多余的二氧化硫,防止污染空气;
(4)装置B中反应的离子方程式SO2 + I2 +2H2O = 4H+ +SO42- +2I-;
(5)A中的溶液,理论上包括溶于水的部分二氧化硫,反应产生的亚铁离子和硫酸根离子,同时溶液显酸性。方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去,说明溶液中存在能与MnO4-反应的物质,亚铁离子和二氧化硫都能将KMnO4还原,故不能确定是否发生了反应;方案②往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色,说明产生了氢氧化亚铁,在空气中迅速被氧化为红褐色氢氧化铁沉淀,说明A中含有亚铁离子,能说明二氧化硫与Fe3+发生了氧化还原反应;方案③往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀,白色沉淀为硫酸钡,说明溶液中有SO42-,二氧化硫被氧化,能说明二氧化硫与Fe3+发生了氧化还原反应。综上所述,上述方案不合理的是方案①,原因是SO2也能使酸性高锰酸钾溶液褪色。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】一氯甲烷与苯的反应如图所示(无机小分子产物略去)。下列说法正确的是
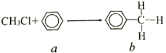
A.该反应属于化合反应
B.a与溴水在铁作催化剂条件下反应生成溴苯
C.b中最多有14个原子共平面
D.b的二氯代物有10种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
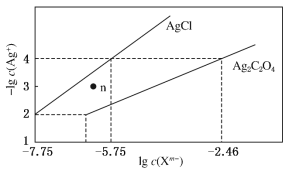
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
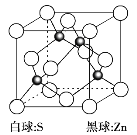
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0 gCu投入50mL 12moL/L的浓硝酸中,充分反应后,收集到4.48L(标准状况)NO和NO2的混合气体。
(1)被还原硝酸的物质的量是_________mol。
(2)判断32.0gCu和50mL 12moL/L的硝酸反应后有剩余的是______________,剩余的物质物质的量为____________________,生成的NO气体体积为(标况下)_________________。
(3)如果往反应后的体系内再加入100mL2mol/L的稀硫酸,充分反应后又有气体逸出。写出反应的离子方程式并用单线桥法表示电子转移的方向和数目 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
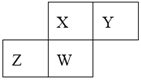
A.最高价氧化物对应水化物的酸性:X>W>Z
B.最简单气态氢化物的热稳定性:Y>X>W>Z
C.原子半径:W>Z>Y>X
D.元素X、Z、W的最高正化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
(1)此时A的浓度为______;
(2)反应开始前放入容器中A、B的物质的量是_____________;
(3)B的平均反应速率是_________________;
(4)x值为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com