
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________。
③FeCl3净水的原理是:___________________________(用离子方程式及适当文字回答);
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。

①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择__________(填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________(填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
【答案】ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 2 Fe3++3H2O3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 硫酸 d a ac
【解析】
(1)①酸性条件下,ClO3-将Fe2+氧化为Fe3+,同时Cl元素化合价从+5价降低为-1价,反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;正确答案:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
②根据溶液电荷守恒可得:2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(OH-)代入数据计算得:c(H+)=c(OH-)+10-2,根据KW=c(H+)× c(OH-)=10-14可知c(OH-)可以忽略不计,则c(H+)≈10-2,故该溶液pH约为2;
③ Fe3+在溶液中发生部分水解:Fe3++3H2O![]() 3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,故可作净水剂;正确答案:Fe3++3H2O
3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,故可作净水剂;正确答案:Fe3++3H2O![]() 3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;
3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;
(2)①使用硫酸,既能保证铁屑被充分溶解,又不引入其它酸根离子;正确答案:硫酸;
②为了不引入其它杂质离子,反应釜中最合适的氧化剂是H2O2,故选d项;
K3[Fe(CN)6]溶液遇Fe2+反应生成蓝色沉淀,因此若溶液中Fe2+未被完全氧化,则产生蓝色沉淀,若Fe2+被完全氧化,则无蓝色沉淀,故选a项;
③a、NaHCO3 可以与 H+反应使得H+浓度降低,使得平衡正向移动,故选a项;
b、水解反应为吸热反应,降低温度使得平衡逆向移动,故不选b项;
c、加水稀释,促进水解,即平衡正向移动,故选c项;
d、NH4Cl水解使溶液显酸性,可以抑制Fe3+水解,平衡逆向移动,故不选d项;
综上分析可知只有ac符合题意;正确选项ac。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】镍氢电池是二次电池,充放电的总反应式是:Ni(OH)2+M![]() MH+NiO(OH),其中M为储氢合金。下列说法正确的是
MH+NiO(OH),其中M为储氢合金。下列说法正确的是
A.放电时,MH在负极发生氧化反应
B.充电时,负极材料的质量变轻
C.放电时正极反应为NiO(OH)+H++e-=Ni(OH)2
D.该电池可以用稀硫酸作电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质M3XY(可视为M2XMY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY: 2M + 2MXA +2MY==2M3XY +A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是
A.简单离子半径:Y>M>X
B.简单氢化物的沸点:X小于Y
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
(1)基态钛原子的价层电子排布图为__________,其原子核外共有______种空间运动状态不同的电子,金属钛的堆积方式如图所示,为________(填堆积方式)堆积
(2)①已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,均高于结构与其相似的CCl4,主要原因是_______。
②TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有______。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.金属键
(3)硫酸氧钛晶体中阳离子为链状聚合形式,结构如图所示,其中Ti-O-Ti在一条直线上。该阳离子化学式为__________,其中O原子的杂化方式为_______。
![]()
(4)2016年7月,研究人员发现了某种钛金合金的化学式是Ti3Au,它具有生物相容性,是理想的人工髋关节和膝关节;其晶胞结构如图所示,晶胞参数为a pm,最近的Ti原子距离为![]() ,A原子的坐标参数为(
,A原子的坐标参数为(![]() ,
,![]() ,
,![]() ),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm
),则B原子坐标参数为_______,距离Ti原子次近的Ti原子有_______个,Ti-Au间最近距离为_______pm

查看答案和解析>>
科目:高中化学 来源: 题型:
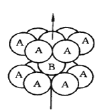
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
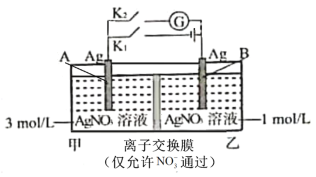
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等
B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 0.5mol雄黄(As4S4),结构如右图,含有NA个S-S键![]()
B. 将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C. 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D. 高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
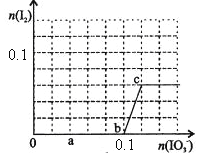
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
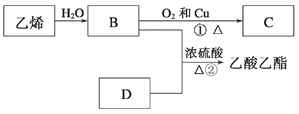
(1)乙烯的结构简式为___________。
(2)C中官能团的名称:__________ D中官能团的名称:__________。
(3)物质B可以被直接氧化为D,需要加入的试剂是_____。
(4)②的反应类型__________。
(5)写出①的化学方程式_________。写出②的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢型阳离子交换树脂(HR)可使水中的钙、镁离子通过离子交换而除去,羟型阴离子交换树脂(ROH)可以使氯离子等阴离子通过离子交换而除去,现代海水的一种淡化方法是使海水(含钙离子、镁离子、钠离子、氯离子等)依次通过两种离子交换树脂A、B (如图所示),
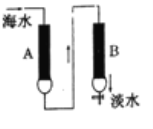
下列叙述中不正确的是( )
A.若两柱中均交换完全,从B处出来的淡水为中性
B.A柱为氢型离子交换树脂(HR), B柱为羟型离子交换树脂(ROH)
C.HR与钙离子的交换可表示为; 2HR+Ca2+=CaR2+2H+
D.两种交换树脂均可以持续使用,无需处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com