
【题目】镍氢电池是二次电池,充放电的总反应式是:Ni(OH)2+M![]() MH+NiO(OH),其中M为储氢合金。下列说法正确的是
MH+NiO(OH),其中M为储氢合金。下列说法正确的是
A.放电时,MH在负极发生氧化反应
B.充电时,负极材料的质量变轻
C.放电时正极反应为NiO(OH)+H++e-=Ni(OH)2
D.该电池可以用稀硫酸作电解质溶液
科目:高中化学 来源: 题型:
【题目】图为CH4燃料电池的装置(A、B为多孔碳棒):
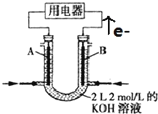
(1)____(填A或B)处电极入口通甲烷,其电极反应式为__________。
(2)该燃料电池工作时溶液中的K+向_____(填A或B)极移动。
(3)现有500 mL KNO3和Cu(N03)2的混合溶液,其中c(NO3-)=6.0mol·L-1,若以CH4燃料电池作为外接电源,且两极均用石墨作电极电解此混合溶液,工作一段时间后,电解池中两极均收集到22.4 L气体(标准状况,下同),则燃料电池消耗CH4体积为________L;假定电解后溶液体积仍为500 mL,原混合溶液中c(K+)为_______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(物质F)是一种香豆素类抗凝剂,在体内有对抗维生素K的作用,可用于预防血栓栓塞性疾病。某种合成华法林的路线如图所示。请回答下列相关问题。

(1)华法林的分子式是_________________。物质E中的含氧官能团名称是_____________。
(2)A→B的氧化剂可以是__________(填标号)。
a.银氨溶液b.氧气
c.新制Cu(OH)2悬浊液d.酸性KMnO4溶液
(3)C→D的化学方程式是_______________________________________________。
(4)E→F的反应类型是______________________。
(5)物质C的同分异构体中符合下列条件的有________________种(不考虑立体异构)。
①含有苯环;②苯环上有两个取代基;③含有-COO-结构且不含甲基
(6)以 和(CH3CO)2O为原料制备
和(CH3CO)2O为原料制备 ,写出合成路线(无机试剂任选)_________
,写出合成路线(无机试剂任选)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置 如右表所示;X的单质在氧气中燃烧能生成两种无色气体, Y的最简单气态氢化物的水溶液显碱性。

回答下列问题:
(1)元素X在周期表中位于________族;W和Z的气态氢化物稳定性比较,其较强的是_______(填化学式)。
(2)W的单质与水反应生成的含氧酸的电子式为_____________。
(3)在BaCl2溶液中加入少量Y的最高价氧化物对应水化物溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀___________(填化学式);ZO2和YO还原性比较,其较强的是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A.图甲是常温下用 0.1000 mol·L-1 NaOH 溶液滴定 20.00mL 0.1000 mol·L-1 CH3COOH 的滴定曲线,说明 Q 点表示酸碱中和滴定终点
B.图乙是 1mol X2(g)、1mol Y2(g)反应生成 2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和
C.图丙是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
D.图丁是光照盛有少量氯水的恒容密闭容器时容器内O2的体积分数变化曲线,说明光照 氯水有O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是

①1 mol阿昔洛韦在催化剂作用下,最多可与5molH2发生加成反应;②属于芳香烃;③是一种易溶于水的醇;④可以被催化氧化;⑤不能使溴水褪色;⑥可以燃烧;
A. ①②③④⑥B. ②④⑤⑥C. ③④⑤⑥D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________。
③FeCl3净水的原理是:___________________________(用离子方程式及适当文字回答);
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。

①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择__________(填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________(填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com