
��14�֣��о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪����Fe2O3(s) + 3C(ʯī) =" 2Fe(s)" + 3CO(g) ��H 1 = +489��0 kJ��mol��1
��C(ʯī) +CO2(g) = 2CO(g) ��H 2 = +172��5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g) CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ������У�����������Ӧ��Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�Ħ�H 0 ���>������<����������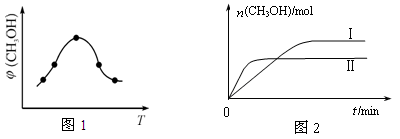
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ��
����̼��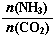 ��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ��
��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ��
����������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬�õ缫��Ӧ�ķ���ʽΪ ��
��1��Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ��H = ��28��5 kJ��mol��1
��2���� 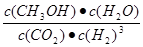 ���ڣ� �� ��>
���ڣ� �� ��>
��3����2��2NH3+CO2 CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O
CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O
�������������(1) �٣��ڡ�3�������ɵ�Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ��H = ��28��5 kJ/mol����2���ٻ�ѧƽ�ⳣ���ǿ��淴Ӧ�ﵽƽ��״̬ʱ����������Ũ�ȵ���ָ���ij˻�����ַ�Ӧ��Ũ�ȵ���ָ���ij˻��ıȡ��Ը÷�Ӧ��˵��K=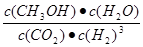 �����ɼ״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵͼʾ��֪������Ӧ�ﵽƽ��������¶ȣ��״������������С��˵�������¶ȣ���ѧƽ�������ƶ�������ƫ���ƶ�ԭ���������¶��λ�����ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ�����Ԧ�H<0�� �����ߢ��I�ȴﵽƽ�⡣˵���¶��¶����ߢ�>I�������¶ȸߣ�CH3OH�����ͣ�˵����ѧƽ�ⳣ��K��>K������3���ٸ��������غ㶨�ɣ���CO2��NH3��һ�������ºϳ�����[CO(NH2)2]�ķ�Ӧ����ʽΪ2NH3+CO2
�����ɼ״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵͼʾ��֪������Ӧ�ﵽƽ��������¶ȣ��״������������С��˵�������¶ȣ���ѧƽ�������ƶ�������ƫ���ƶ�ԭ���������¶��λ�����ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ�����Ԧ�H<0�� �����ߢ��I�ȴﵽƽ�⡣˵���¶��¶����ߢ�>I�������¶ȸߣ�CH3OH�����ͣ�˵����ѧƽ�ⳣ��K��>K������3���ٸ��������غ㶨�ɣ���CO2��NH3��һ�������ºϳ�����[CO(NH2)2]�ķ�Ӧ����ʽΪ2NH3+CO2 CO(NH2)2+H2O��
CO(NH2)2+H2O��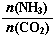 ��3������n(CO2)=amol,��n(NH3)=3amol�����ڴ�ƽ��ʱCO2��ת����Ϊ60%�����Է�Ӧ���ĵ�n(CO2)=0��6amol�������ݷ���ʽ�ж��ߵ����ʵ����Ĺ�ϵ��֪��Ӧ��NH3�����ʵ���n(NH3)=1��2amol����������ת����Ϊ(1��2amol����3amol)��100%=40%������������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬���������ɵã��õ缫��Ӧ�ķ���ʽΪCO2+8e��+8H+=CH4+2H2O��
��3������n(CO2)=amol,��n(NH3)=3amol�����ڴ�ƽ��ʱCO2��ת����Ϊ60%�����Է�Ӧ���ĵ�n(CO2)=0��6amol�������ݷ���ʽ�ж��ߵ����ʵ����Ĺ�ϵ��֪��Ӧ��NH3�����ʵ���n(NH3)=1��2amol����������ת����Ϊ(1��2amol����3amol)��100%=40%������������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬���������ɵã��õ缫��Ӧ�ķ���ʽΪCO2+8e��+8H+=CH4+2H2O��
���㣺�����Ȼ�ѧ����ʽ����д����ѧƽ�ⳣ���ı���ʽ���¶ȶԻ�ѧƽ�ⳣ����Ӱ�졢����ת���ʡ��绯ѧ�缫ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ྦྷ�����������������£�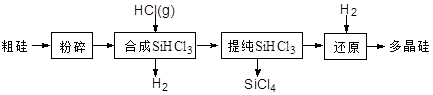
��1���ֹ�����Ŀ���� ������SiHCl3 (l)��SiCl4(l)�ķ���Ϊ ��
��2��900�����ϣ� H2��SiHCl3�������·�Ӧ��SiHCl3 (g)+ H2 (g)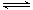 Si (s) + 3HCl (g) ��H ��0����ƽ�ⳣ������ʽΪK = ��Ϊ���ԭʱSiHCl3��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
Si (s) + 3HCl (g) ��H ��0����ƽ�ⳣ������ʽΪK = ��Ϊ���ԭʱSiHCl3��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
��3���������п���ѭ��ʹ�õ������� ��
��4��SiCl4�����������еĵ��ʷ������Ϸ�Ӧ�������Ƶ�SiHCl3���仯ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������̼��̼�Ļ���������������ʵ����Ӧ�ù㷺��
(1)��2�����ܱ������У�����2mol CO��4mol ˮ�������ڴ��������½������»�ѧ��Ӧ��CO(g)+H2O(g) CO2(g)+H2(g)��CO��ת���ʺ��¶�t�Ĺ�ϵ���±���
CO2(g)+H2(g)��CO��ת���ʺ��¶�t�Ĺ�ϵ���±���
| t(��) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
 CH3OH(g)+H2O(g) ��H��-49.0 kJ��mol��1���������Ϊ1 L���ܱ������У�����
CH3OH(g)+H2O(g) ��H��-49.0 kJ��mol��1���������Ϊ1 L���ܱ������У�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�
2SO2(g)��O2(g) 2SO3(g)����H<0
2SO3(g)����H<0
��1)�÷�Ӧ450��ʱ��ƽ�ⳣ�� 500��ʱ��ƽ�ⳣ��(����ڡ�����С�ڡ����ڡ�)��
��2)��һ���̶��ݻ�Ϊ5L���ܱ������г���0.20 mol SO2��0. 10molO2������Ӻ�ﵽƽ�⣬��������к�SO30.18mol����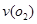 = mol.L-1.min-1��������ͨ��0.20mol SO2��0.10mol O2����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ���� ����)
= mol.L-1.min-1��������ͨ��0.20mol SO2��0.10mol O2����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ���� ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
(14��)��ҵ������·ѭ����������������Ĺ�����������ͼ��ʾ��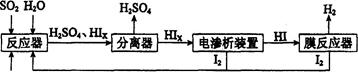
�ش��������⣺
��1���ڷ�Ӧ���з�����Ӧ�Ļ�ѧ����ʽ��______________��
��2����Ĥ��Ӧ���з�����Ӧ��2HI(g) H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��
H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��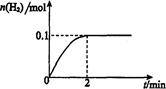
�ٸ��¶��£���Ӧƽ�ⳣ��K=_______���������¶ȣ�Kֵ��_______
(���������������?��)��
���û�ѧƽ��ԭ������ʹ��Ĥ��Ӧ����ʱ�����H2��Ŀ����___________________
��3��������װ������ͼ��ʾ��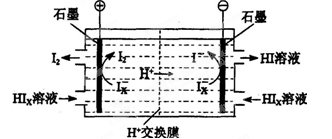
�ٽ�ϵ缫��Ӧʽ����������HIxת��ΪHI��ԭ����______________________________
�ڸ�װ���з������ܷ�Ӧ�Ļ�ѧ����ʽ��________________________
��4����������������ѭ�����õ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��16�֣����������������������и�Ч���������̼�����������Ҫ�ɷ�H2O2��
��1��H2O2���ȶ����ֽ⣬Fe3����Cu2���ȶ���ֽ�������ã�Ϊ�Ƚ�Fe3����Cu2����H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С��ͬѧ�ֱ�����˼ס�������ʵ��װ�á�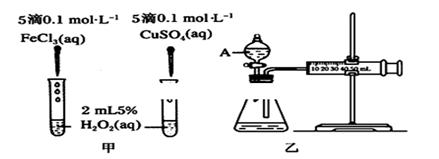
�����ü�ʵ�飬��ͨ���۲�________���Ӷ����ԱȽϵó����ۡ���ͬѧ�����FeCl3��ΪFe2(SO4)3��Ϊ��������������________����������ʵ��ɽ��ж���������ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ʵ���л���Ҫ������������________��
��2���ں��б�����Լ�������ˮ��Һ�У���̼Ϊ�缫��ֱͨ������е�����ȡ�����������⣬���������� ���������������������������
��H2O2�����⻯����NaBH4��B�Ļ��ϼ�Ϊ+3�ۣ���ԭ�ϵ�ȼ�ϵ�أ�������ͨ�����ǵ�Դ���乤��ԭ����ͼ��ʾ��д��a���ϵĵ缫��Ӧʽ�� ���������ϲ���MnO2��MnO2�������缫����֮����ܾ��е�����Ϊ 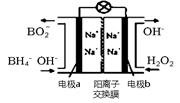
��3���ࣨGe����̼��ͬ����Ԫ�أ������о������л���������ԵĿ��������ԣ����NaOH ��Һ��Ӧ��������H2O2����ʱ����NaOH ��Һ��Ӧ���������Σ��仯ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣�ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4 + 5H2C2O4 + 3H2SO4�� K2SO4 + 2MnSO4 + 10CO2�� + 8H2O
��ʵ�����ݼ���¼��
| ʵ���� | �����£��Թ��������Լ��������� / mL | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |

| ʵ���� | �����£��Թ��������Լ��������� / mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05 mol/L KMnO4��Һ | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣� 2SO2(g)+ O2 (g)  2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�
2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�
| �¶�/�� | 400 | 500 | 600 |
| SO2ת����/% | 99��2 | 93��5 | 73��7 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��������β���Ǽ��ٳ��п�����Ⱦ���ȵ��о����⡣
��1��������ȼ������ʱ�����ķ�ӦN2(g) + O2(g) 2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T ��ʱ����5L�ܱ������г���6.5 molN2��7.5 molO2����5 minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ�����5 mol�������Ǻ�����Ӧ������
2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T ��ʱ����5L�ܱ������г���6.5 molN2��7.5 molO2����5 minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ�����5 mol�������Ǻ�����Ӧ������
��5 min�ڸ÷�Ӧ��ƽ�����ʦ�(NO) = ����T ��ʱ���÷�Ӧ��ƽ�ⳣ��K = ��
�� ��Ӧ��ʼ���ﵽƽ��Ĺ����У����������и�����仯���� ������ţ���
a�����������ܶ� b����������ѹǿ
c������Ӧ���� d����λʱ���ڣ�N2��NO��������֮��
��2����H2��CO����ԭNO���Դﵽ������Ⱦ��Ŀ�ġ�
��֪��2NO(g) = N2(g) + O2(g) ? ��H =" ��180.5" kJ��mol��1
2H2O(l) =2H2(g) + O2(g) ?��H =" +571.6" kJ��mol��1
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽ��
��
��3��������һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ��ʾ��������������ʱ����Ӧ2NO(g) + 2CO(g)
 2CO2(g) + N2(g) �У�NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
2CO2(g) + N2(g) �У�NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
�� �÷�Ӧ��?H 0 ���������������
���������ı����S1��S2 ������ͼ�л���c(NO) ��T1�� S2 �����´ﵽƽ������еı仯���ߣ�������Ӧ��ע����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com