
(14分) 2SO2(g)+ O2 (g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |


(14分)
(1)放热 0.08
(2)①ac
i. SO2+ H2O H2SO3 MnO2+ H2SO3===MnSO4+H2O(或MnO2+ SO2==MnSO4)
H2SO3 MnO2+ H2SO3===MnSO4+H2O(或MnO2+ SO2==MnSO4)
ii. 2SO2+ 2H2O +O2 ="==" 2H2SO4
不利于 溶液中存在 SO2+ H2O  H2SO3
H2SO3 H++,当溶液中酸性增强,平衡向左移动,使SO2从体系中溢出。
H++,当溶液中酸性增强,平衡向左移动,使SO2从体系中溢出。
解析试题分析:(1)温度升高二氧化硫的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应;
(2)该条件下二氧化硫的转化率为99.2%,所以10 mol SO2的原料气平衡时剩余10×(1-99.2%)=0.08mol SO2
(3)①根据物料守恒规律,c(NH4+)+c(NH3·H2O)=2c(H2SO3)+2c(SO32-)+ 2c(HSO3-),a正确;b不符合电荷守恒规律,错误;(NH4)2SO3溶液为碱性溶液,说明SO32-的水解程度大于NH4+的水解程度,所以溶液中离子浓度的大小关系是c(NH4+)>c(SO32-)>c(OH-)>c(H+),c正确;答案选ac;
②i.二氧化硫与水反应生成亚硫酸,亚硫酸与二氧化锰发生氧化还原反应生成硫酸锰,化学方程式为H2O+SO2 H2SO3 MnO2+ H2SO3= MnSO4+H2O;
H2SO3 MnO2+ H2SO3= MnSO4+H2O;
ii.SO2与水、氧气反应生成硫酸,化学方程式为2SO2+2H2O+ O2="2" H2SO4;由乙图可知,pH减小,二氧化硫的吸收率下降,所以pH的降低不利于SO2的吸收;因为二氧化硫溶于水后存在平衡H2O+SO2 H2SO3
H2SO3 H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
考点:考查反应的能量变化,化学平衡的移动,溶液中离子浓度的大小比较,化学方程式的判断与书写


科目:高中化学 来源: 题型:填空题
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: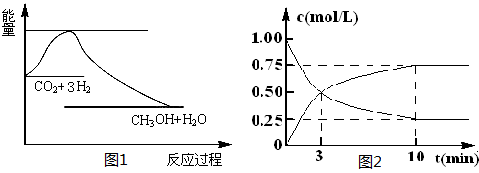
(1)关于该反应的下列说法中,正确的是 (填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
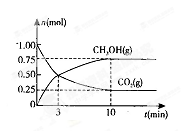
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有 ;其正极的电极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0 (填“>”、“<”或“=”)。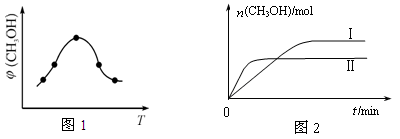
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。
当氨碳比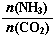 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
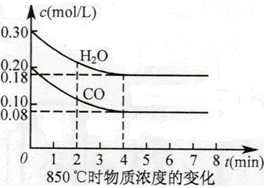
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。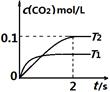
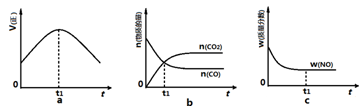
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)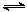 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。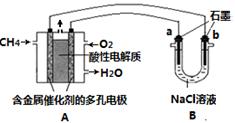
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g) △H= 。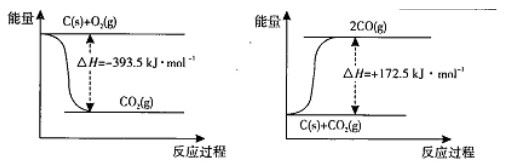
(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H2,一定
条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如右图所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3) CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 | H2CO3 | NH3.H2O |
| 电离平衡常数( 25℃) | Ka1=" " 4.30 × 10一7 Ka2=" " 5.61× 10一11 | Kb = 1.77× 10一5 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(8分)某温度时,在0.5L密闭容器中某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
(1)该反应的化学方程式为______________________________。
(2)反应开始至4min时,B的平均反应速率为____________。
(3)平衡时A的转化率为________。第4min时,正逆反应速率的大小关系为:υ(正)___υ(逆)(填“>”、“<”或“=”,下同),第8min时,υ(正)___υ(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
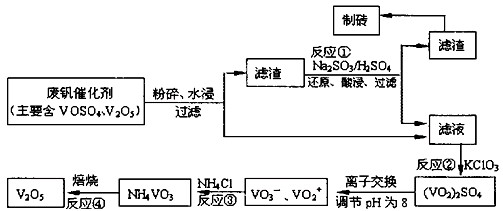
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____;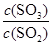 增大的是_____。
增大的是_____。查看答案和解析>>
科目:高中化学 来源: 题型:实验题
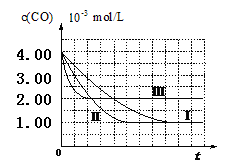
(12分)根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO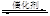 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | | | | | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | | | 80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com