
碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g) △H= 。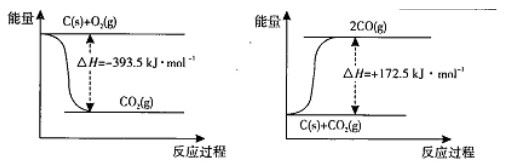
(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H2,一定
条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
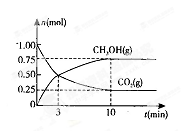
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如右图所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3) CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 | H2CO3 | NH3.H2O |
| 电离平衡常数( 25℃) | Ka1=" " 4.30 × 10一7 Ka2=" " 5.61× 10一11 | Kb = 1.77× 10一5 |

科目:高中化学 来源: 题型:填空题
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 ;
(2)检验溶液B中是否存在Fe3+的方法是 ;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 ;
(Ⅱ)(1) 常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | 氨水物质的量浓度 (mol·L-1) | 盐酸物质的量浓度 (mol·L-1) | 混合溶液 pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。
(1)H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。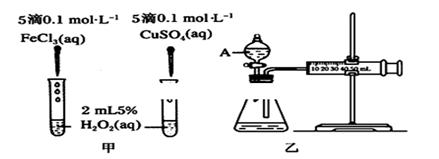
若利用甲实验,可通过观察________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作通信卫星电源。其工作原理如图所示,写出a极上的电极反应式: ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为 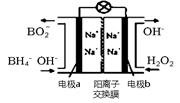
(3)锗(Ge)与碳是同主族元素,最新研究表明有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应,但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分) 2SO2(g)+ O2 (g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |


查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g)  x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比是多少?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(4分)在一固定容积的密闭容器中,a mol/LN2和b mol/L H2反应,一定条件下经过2min达到平衡,生成c mol/L NH3.
求:(1)用H2表示的速率是多少?(2)N2的转化率是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-═2SO42-+I2(慢),I2+2S2O32-═S4O62-+2I- (快),
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变成为 色。为确保能观察到该现象,S2O32—与S2O82—初始的物质的量需满足的范围为:n(S2O32—):n(S2O82—) 。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: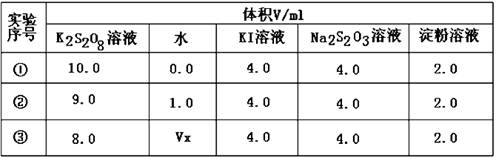
表中Vx= mL,反应速率最快的是 (填序号)。
(3)已知图中A曲线为某条件下,浓度c(S2O82—)~ 反应时间t的变化曲线图,若保持
其他条件不变, (填“B”或“C”)曲线为降低反应温度, (填“B”或“C”)曲线为加入催化剂。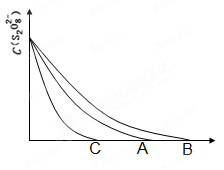
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com