
【题目】电解已广泛应用于金属冶炼、污水的处理等工业。
(1)新型的钛基纳米PbO2电极材料制备:在钛板上先形成一层铝膜,在草酸溶液中作阳极氧化为氧化铝同时形成孔洞,再在Pb(NO3)2溶液中浸泡电解形成纳米PbO2,用氢氧化钠溶液浸泡除去多余的氧化铝,获得钛基纳米PbO2电极。
①钛基板打磨后用丙酮浸泡,再用水冲洗,用丙酮浸泡的作用是 。
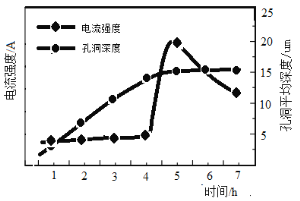
②阳极氧化时溶液中电流强度和基板孔洞深度随时间变化如下图所示,氧化的终点电流突然增加的原因是 。电极氧化成孔洞时温度需严格控制在8℃左右,温度不宜过高的原因是 。
③电解形成纳米PbO2时阳极电极反应式为 。工业上可以用Na2S2O8溶液氧化Pb(NO3)2制备PbO2,其离子方程式为 。
(2)PbO2做阳极电解处理污水
①用PbO2材料做阳极处理污水的效果明显优于石墨电极,其原因可能是 。
②某小组用自己制作的钛基纳米PbO2电极电解处理污水,发现污水澄清效果优于购买的标准钛基纳米PbO2电极。此钛基纳米PbO2电极的EDX能图谱信息如下图,其去污效果好的原因可能是 。

【答案】每空2分
(1)①除去钛基表面的有机物(油污)
②铝氧化完成,形成的空洞到达金属钛的表面,金属钛导电
防止温度高氧化铝溶解,不能形成孔洞
③Pb2++2H2O-2e-=PbO2+4H+
Pb2++ S2O82-+2H2O=PbO2↓+2SO42- +4H+
(2)①PbO2具有催化作用
②电极板中含有金属铝,电解时铝溶解形成氢氧化铝胶体吸附污水中的杂质
【解析】
试题分析:
(1)①金属表面的油污可以用热的纯碱或有机溶剂洗去;
②图像中含有两条曲线,一条是电流强度,另一条是孔洞深度,显然当孔洞深度不变时电流强度突然增加,即孔洞到底了,金属钛的导电能力强,没有打通之前表面是氧化铝,导电能力差;氧化铝和铝均溶解于强酸,当温度高时可能溶解于草酸溶液导致不能形成孔洞;
③阳极失去电子,应是Pb2+变成PbO2,电极反应式为Pb2++2H2O-2e-=PbO2+4H+;反应物为Na2S2O8 和Pb(NO3)2,产物为PbO2,所以反应为 Pb2++ S2O82-+2H2O=PbO2↓+2SO42- +4H+
(2)①电解效果好即反应速率快,因素有温度、浓度、催化剂等,电解中只可能是催化剂的因素了,也就是说PbO2可以为电解的催化剂,加快反应速率;
②澄清效果好应考虑到过滤或胶体等的吸附作用,图像中获得电极中含有铝元素,电解时产生铝离子水解为氢氧化铝胶体,吸附污水中的悬浮物而沉淀,加速污水的澄清。


科目:高中化学 来源: 题型:
【题目】下列有关钠的物理性质的叙述中正确的是
①银白色金属 ②质软,可以用小刀切割
③熔点低于100℃④密度比水小
⑤热和电的良导体
A.①②④ B.①②③④ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,lmoI丙烷共用电子对数为10 NA
B. 0.5 moI甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA
C. 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为![]()
D. 1 mol甲醇与足量钠反应,转移电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A.KMnO4
B.Ca(ClO)2
C.Cl2
D.H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C. SO2、SO3、BF3、NCl3都是极性分子
D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。
(1)已知:黄铁矿中的硫元素在酸性条件下可被![]() 氧化成
氧化成![]() ,若生成标准状况下3.36 L ClO2气体,至少需要黄铁矿的质量为 。
,若生成标准状况下3.36 L ClO2气体,至少需要黄铁矿的质量为 。
(2)工业上以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品3.0 g,通过反应和吸收获得200 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.040 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
①写出ClO2溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式 。
②试计算ClO2的“产率”(写出计算过程) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比2∶3∶3配制浓硫酸、乙醇和乙酸的混合溶液。
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5 ~ 10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置。
请根据题目要求回答下列问题:

(1)乙酸分子中所含官能团的名称是______________________。
(2)配制该混合液时,滴加药品的顺序是_______________________________。
(3)浓硫酸的主要作用是________,试管B中饱和碳酸钠溶液的作用是__________。
(4)导管不能插入到Na2CO3溶液中的原因是_____________________________。
(5)做此实验时,有时还向A试管里加入几块碎瓷片,其目的是________________。
(6)指出步骤③所观察到的现象:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
第ⅤA族的氮、磷、砷等元素在化合物中常表现出多种价态,含第ⅤA族元素的化合物在科学研究和生产中有许多重要用途。请回答下列问题:
(1)基态砷原子的核外电子排布式为____________,有__________个未成对电子。
(2)氨的沸点 (填“高于”或“低于”)膦(PH3);AsCl3分子中中心原子的轨道杂化类型为_______。
(3)硝酸中酸根离子的空间构型是_________;HNO3比 HNO2酸性强的原因是__________________。
(4)氮化硼(BN)是一种重要的功能陶瓷材料,B、N和O相比,电负性较大的是_____;在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为_____。
(5)立方氮化硼是由六方氮化硼和触媒在高温高压下合成的,它具有很高的硬度、热稳定性和化学惰性,立方氮化硼的晶体类型是______。立方氮化硼的晶胞如图所示,已知晶胞参数a=361.5 pm,立方氮化硼的密度是________ g·cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com