
【题目】【化学——选修3:物质结构与性质】
第ⅤA族的氮、磷、砷等元素在化合物中常表现出多种价态,含第ⅤA族元素的化合物在科学研究和生产中有许多重要用途。请回答下列问题:
(1)基态砷原子的核外电子排布式为____________,有__________个未成对电子。
(2)氨的沸点 (填“高于”或“低于”)膦(PH3);AsCl3分子中中心原子的轨道杂化类型为_______。
(3)硝酸中酸根离子的空间构型是_________;HNO3比 HNO2酸性强的原因是__________________。
(4)氮化硼(BN)是一种重要的功能陶瓷材料,B、N和O相比,电负性较大的是_____;在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为_____。
(5)立方氮化硼是由六方氮化硼和触媒在高温高压下合成的,它具有很高的硬度、热稳定性和化学惰性,立方氮化硼的晶体类型是______。立方氮化硼的晶胞如图所示,已知晶胞参数a=361.5 pm,立方氮化硼的密度是________ g·cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。

【答案】
(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3(2分) 3(1分)
(2)高于(1分) sp3(2分)
(3)平面三角形(1分)
HNO3和HNO2可表示为(HO)NO2和(HO)NO,HNO2中的N为+3价,而HNO3中的N为+5价,正电性更高,导致N—O—H中O的电子更向N偏移,越易电离出H+(2分)
(4)O(1分) 共价键(或极性共价键)(1分) 分子间作用力(或范德华力) (1分)
(5)原子晶体(1分) ![]() (2分)
(2分)
【解析】
试题分析:
(1)As是33号元素,在元素周期表中位于第四周期第ⅤA族,基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3,基态As原子有3个未成对的电子。
(2)氨气分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3);根据价层电子对互斥理论,AsCl3中心原子As的σ键电子对数等于3,孤电子对数=(53)÷2=1,则中心原子As是sp3杂化;
(3)硝酸根离子中N元素的价层电子对数是3,不存在共用电子对,其空间构型是平面三角形;HNO3和HNO2可表示为(HO)NO2和(HO)NO,HNO2中的N为+3价,而HNO3中的N为+5价,正电性更高,导致N—O—H中O的电子更向N偏移,越易电离出H+。
(4)因为同一周期元素,随着原子序数的增大,电负性逐渐增大,故电负性较大的是O;因为六方氮化硼的结构与石墨类似,故其晶体中也是分层结构,层间是分子间作用力,层内的B原子与N原子间是极性共价键。
(5)立方氮化硼是由六方氮化硼和触媒在高温高压下合成的,它具有很高的硬度、热稳定性和化学惰性,立方氮化硼的晶体类型是原子晶体。根据均摊法及BN的化学式可推知,一个晶胞中各含有4个B原子、4个N原子;因一个晶胞的体积是(361.5×1010)3 cm3,根据密度=质量÷体积可知晶胞的密度是![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】电解已广泛应用于金属冶炼、污水的处理等工业。
(1)新型的钛基纳米PbO2电极材料制备:在钛板上先形成一层铝膜,在草酸溶液中作阳极氧化为氧化铝同时形成孔洞,再在Pb(NO3)2溶液中浸泡电解形成纳米PbO2,用氢氧化钠溶液浸泡除去多余的氧化铝,获得钛基纳米PbO2电极。
①钛基板打磨后用丙酮浸泡,再用水冲洗,用丙酮浸泡的作用是 。
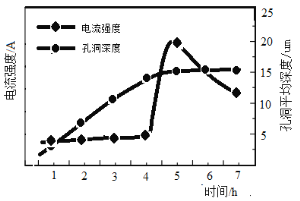
②阳极氧化时溶液中电流强度和基板孔洞深度随时间变化如下图所示,氧化的终点电流突然增加的原因是 。电极氧化成孔洞时温度需严格控制在8℃左右,温度不宜过高的原因是 。
③电解形成纳米PbO2时阳极电极反应式为 。工业上可以用Na2S2O8溶液氧化Pb(NO3)2制备PbO2,其离子方程式为 。
(2)PbO2做阳极电解处理污水
①用PbO2材料做阳极处理污水的效果明显优于石墨电极,其原因可能是 。
②某小组用自己制作的钛基纳米PbO2电极电解处理污水,发现污水澄清效果优于购买的标准钛基纳米PbO2电极。此钛基纳米PbO2电极的EDX能图谱信息如下图,其去污效果好的原因可能是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在工农业上有重要作用。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为_________
(用化学式表示);
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为____________;
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如右图所示。

①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为____________;
=6,则FexOy的化学式为____________;
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为____________。
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________(填标号)。
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4molCO2和8molH2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=______________;
KA、KB、KC三者之间的大小关系为_____________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3-;反应NH4++HCO3+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。
NH3·H2O+H2CO3的平衡常数K=__________。
(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92gCu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
A. 504mL B. 224 mL C. 336 mL D. 168 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000 mol/L KOH溶液滴定20.00 mL 0.1000 mol/L CH3COOH溶液,滴定中pH变化如图,下列关系错误的是

A.V=0.00mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol/L
B.V=10.00mL时,溶液中2c(K+)=c(CH3COO-)+c(CH3COOH)
C.V≥20.00mL时,溶液中一定有c(K+)>c(CH3COO-)>c(OH-)> c(H+)
D.溶液pH=7时,![]() =1
=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不涉及氧化还原反应的是( )
A. 钢铁生锈 B. 用铂丝蘸取NaCl溶液进行焰色反应
C. 自然界中“氮的固定” D. 铜铸塑像上出现铜绿[Cu2(OH)2CO3]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com