
【题目】碳及其化合物在工农业上有重要作用。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为_________
(用化学式表示);
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为____________;
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如右图所示。

①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为____________;
=6,则FexOy的化学式为____________;
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为____________。
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________(填标号)。
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4molCO2和8molH2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=______________;
KA、KB、KC三者之间的大小关系为_____________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3-;反应NH4++HCO3+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。
NH3·H2O+H2CO3的平衡常数K=__________。
(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
【答案】 CO、H2 2MgSO4 + CO![]() 2MgO + SO2 +SO3 +CO2 Fe3O4 2mol c 0.12mol·L-1·min-1 KA=KC>KB > 1.25×10-3
2MgO + SO2 +SO3 +CO2 Fe3O4 2mol c 0.12mol·L-1·min-1 KA=KC>KB > 1.25×10-3
【解析】(1)水煤气的主要成分为CO、H2;(2)高温时,用CO还原MgSO4可制备高纯度MgO,同时还有CO2生成。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则根据原子守恒可知反应的化学方程式为2MgSO4 + CO![]() 2MgO + SO2 +SO3 +CO2;(3)①根据流程知“重整系统”氧化亚铁和二氧化碳反应生成铁的氧化物和碳,当氧化亚铁和二氧化碳的物质的量之比为6时根据原子守恒确定FexOy的化学式为Fe3O4。②四氧化三铁分解的方程式为Fe3O4=3FeO+1/2O2↑,因此“热分解系统”中每分解1mol FexOy,生成0.5mol氧气,转移电子的物质的量为2mol。(4)①a.增大生成物的浓度,逆反应速率先增大后减小,平衡逆向移动,a错误;b.减小反应物的浓度,反应物的体积百分含量减小,平衡逆向移动,b错误;c.H2的转化率增大,平衡一定向正反应方向移动,c正确;d.减小二氧化碳的浓度,平衡逆向移动,容器中的
2MgO + SO2 +SO3 +CO2;(3)①根据流程知“重整系统”氧化亚铁和二氧化碳反应生成铁的氧化物和碳,当氧化亚铁和二氧化碳的物质的量之比为6时根据原子守恒确定FexOy的化学式为Fe3O4。②四氧化三铁分解的方程式为Fe3O4=3FeO+1/2O2↑,因此“热分解系统”中每分解1mol FexOy,生成0.5mol氧气,转移电子的物质的量为2mol。(4)①a.增大生成物的浓度,逆反应速率先增大后减小,平衡逆向移动,a错误;b.减小反应物的浓度,反应物的体积百分含量减小,平衡逆向移动,b错误;c.H2的转化率增大,平衡一定向正反应方向移动,c正确;d.减小二氧化碳的浓度,平衡逆向移动,容器中的![]() 值变小,d错误,答案选c。②分析图像知T1温度下,将4mol CO2和8mol H2充入2 L的密闭容器中,5 min后反应达到平衡,CO2的转化率为60%,则参加反应的二氧化碳的物质的量为2.4mol,生成二甲醚的物质的量为1.2mol,则0~5 min内的平均反应速率v (CH3OCH3) =1.2mol÷(2L×5min)=0.12mol/(L·min);③合成二甲醚的反应为放热反应,升高温度平衡向逆反应方向进行,CO2的转化率降低,因此温度T2大于T1。平衡常数只与温度有关系,则KA、KB、KC三者之间的大小关系为KA=KC>KB ;(5)分析题给电离常数知一水合氨的电离程度大于碳酸的一级电离程度,则碳酸氢根的水解程度大于铵离子的水解程度,则NH4HCO3溶液中,c(NH4+)>c(HCO3-);反应NH4++HCO3-+H2O
值变小,d错误,答案选c。②分析图像知T1温度下,将4mol CO2和8mol H2充入2 L的密闭容器中,5 min后反应达到平衡,CO2的转化率为60%,则参加反应的二氧化碳的物质的量为2.4mol,生成二甲醚的物质的量为1.2mol,则0~5 min内的平均反应速率v (CH3OCH3) =1.2mol÷(2L×5min)=0.12mol/(L·min);③合成二甲醚的反应为放热反应,升高温度平衡向逆反应方向进行,CO2的转化率降低,因此温度T2大于T1。平衡常数只与温度有关系,则KA、KB、KC三者之间的大小关系为KA=KC>KB ;(5)分析题给电离常数知一水合氨的电离程度大于碳酸的一级电离程度,则碳酸氢根的水解程度大于铵离子的水解程度,则NH4HCO3溶液中,c(NH4+)>c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=Kw/KbK1=1.25×10-3。
NH3·H2O+H2CO3的平衡常数K=Kw/KbK1=1.25×10-3。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列有关钠的物理性质的叙述中正确的是
①银白色金属 ②质软,可以用小刀切割
③熔点低于100℃④密度比水小
⑤热和电的良导体
A.①②④ B.①②③④ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。
(1)已知:黄铁矿中的硫元素在酸性条件下可被![]() 氧化成
氧化成![]() ,若生成标准状况下3.36 L ClO2气体,至少需要黄铁矿的质量为 。
,若生成标准状况下3.36 L ClO2气体,至少需要黄铁矿的质量为 。
(2)工业上以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品3.0 g,通过反应和吸收获得200 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.040 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
①写出ClO2溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式 。
②试计算ClO2的“产率”(写出计算过程) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比2∶3∶3配制浓硫酸、乙醇和乙酸的混合溶液。
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5 ~ 10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置。
请根据题目要求回答下列问题:

(1)乙酸分子中所含官能团的名称是______________________。
(2)配制该混合液时,滴加药品的顺序是_______________________________。
(3)浓硫酸的主要作用是________,试管B中饱和碳酸钠溶液的作用是__________。
(4)导管不能插入到Na2CO3溶液中的原因是_____________________________。
(5)做此实验时,有时还向A试管里加入几块碎瓷片,其目的是________________。
(6)指出步骤③所观察到的现象:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大马酮是一种主要用于高级化妆品和食品的香料,可通过紫罗兰酮A以下列方法合成:
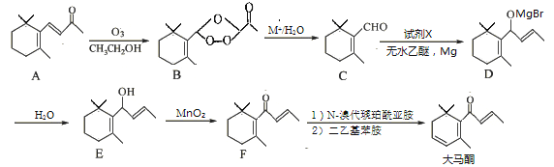
(1)B中的含氧官能团名称为 和 。
(2)D→E的反应类型为 。
(3)试剂X的分子式为C3H5Br,X的结构简式为 。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应;
②分子中只有5种不同化学环境的氢。
(5)请以氯化苄![]() 和溴乙烷为原料制备苯丙烯
和溴乙烷为原料制备苯丙烯 ![]() ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是____。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 g MoO3,反应中转移电子的数目为______。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是 (填序号)。
a. Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_______________________。
能提高该反应速率的措施有_______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式________________。
(6)已知钼酸钠溶液中c(![]() )=0.40 mol·L1,c(
)=0.40 mol·L1,c(![]() )=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去
)=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去![]() 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时,![]() 的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
第ⅤA族的氮、磷、砷等元素在化合物中常表现出多种价态,含第ⅤA族元素的化合物在科学研究和生产中有许多重要用途。请回答下列问题:
(1)基态砷原子的核外电子排布式为____________,有__________个未成对电子。
(2)氨的沸点 (填“高于”或“低于”)膦(PH3);AsCl3分子中中心原子的轨道杂化类型为_______。
(3)硝酸中酸根离子的空间构型是_________;HNO3比 HNO2酸性强的原因是__________________。
(4)氮化硼(BN)是一种重要的功能陶瓷材料,B、N和O相比,电负性较大的是_____;在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为_____。
(5)立方氮化硼是由六方氮化硼和触媒在高温高压下合成的,它具有很高的硬度、热稳定性和化学惰性,立方氮化硼的晶体类型是______。立方氮化硼的晶胞如图所示,已知晶胞参数a=361.5 pm,立方氮化硼的密度是________ g·cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式符合表述的是( )
A. 泡沫灭火器原理:3 CO32-+ 2Al3++3H2O=== 2Al(OH)3↓+ 3CO2↑
B. NaHCO3 溶液水解方程式:HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
C. 酸性高锰酸钾溶液氧化草酸:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+ 8 H2O
D. 向苯酚钠溶液中通入少量的 CO2 气体![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com