
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
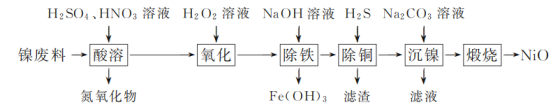
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“除铁”时需控制溶液的pH范围为________。
(2)“滤渣”的主要成分为________(填化学式)。
(3)“沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
【答案】3.3≤pH<7.7 CuS xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
(x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
【解析】
以镍废料(主要成分为镍铁合金,含少量铜)为原料,加入硫酸、硝酸酸浸,Ni转化为NiSO4,同时生成亚铁离子、铁离子、铜离子等,加入过氧化氢,可氧化亚铁离子生成铁离子,加入氢氧化钠调节pH可生成氢氧化铁沉淀,然后通入硫化氢生成CuS沉淀,达到除铜的目的,在滤液中加入碳酸钠溶液可生成xNiCO3yNi(OH)2,煅烧可生成NiO;
(1)根据表格数据分析“除铁”时要求铁离子全部除掉需要的pH;
(2) S2-可与Cu2+反应生成CuS沉淀;
(3)①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,xNiCO3·yNi(OH)2高温下分解生成NiO、CO2和H2O;
②pH越大,溶液碱性越强,结合碱式碳酸镍[用xNiCO3·yNi(OH)2表示]组成分析;
(1) “除铁”时要求铁离子全部除掉,pH![]() 3.3,镍离子和铜离子留在溶液中,pH<7.7,所以需控制溶液的pH范围为3.3≤pH<7.7;
3.3,镍离子和铜离子留在溶液中,pH<7.7,所以需控制溶液的pH范围为3.3≤pH<7.7;
(2)向除铁后的滤液中通入H2S气体,发生反应H2S+Cu2+=CuS↓+2H+,因此滤渣的成分为CuS;
(3)①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,xNiCO3·yNi(OH)2高温下分解生成NiO、CO2和H2O,其化学方程式为:xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O;
(x+y)NiO+xCO2↑+yH2O;
②碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀中Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大,所以碱式碳酸镍中Ni元素含量会增加。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应M(g)+N(g) ![]() P (g)+Q(g) ,请回答下列问题:
P (g)+Q(g) ,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 molL-1,c(N)=2.4 molL-1,达到平衡后,M的转化率为60%,此时N的转化率为__________ ;该温度时K=_________。
(2)若温度升高K值增大,则该反应为______反应。(填“吸热”或“放热”)。理由_________________。
(3)若反应温度升高,M的转化率______(填“增大”“减小”或“不变”;)
(4)若反应温度不变,反应物的起始浓度分别为:c(M)= 4molL-1, c(N)=a molL-1;达到平衡后,c(P)=2 molL-1,a=________。
(5)若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b molL-1,达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和H2在生产、生活、科技中是重要的燃料。
①2C(s)+O2(g) ===2CO(g) ΔH1=—220 kJ/mol
②
下列推断正确的是
A. C(s)的燃烧热110kJ/mol
B. 2H2(g)+O2(g)===2H2O(g)ΔH1=+480kJ/mol
C. C(s)+H2O(g)===CO(g)+H2(g)ΔH1=+130kJ/mol
D. 欲分解2molH2O(l),至少需要提供4×462kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3kJ/mol 结论:CH4的燃烧热为801.3kJ/mol
B. Sn(s,灰) ![]() Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
C. 稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol结论:将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则会放出57.3kJ的能量
D. C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 结论:相同条件下金刚石性质比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法。某研究性学习小组将下列装置如图连接,D、E、X、Y都是铂电极、C、F是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)B极的名称是___。
(2)甲装置中电解反应的总化学方程式是:___。
(3)设电解质溶液过量,电解后乙池中加入___(填物质名称)可以使溶液复原。
(4)设甲池中溶液的体积在电解前后都是500ml,乙池中溶液的体积在电解前后都是200mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为___mol/L;乙池中溶液的pH=___;
(5)装置丁中的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]()
![]()
![]()
![]() 。一定条件下,向容积为
。一定条件下,向容积为![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化的曲线如图所示。下列叙述中正确的是( )
的浓度随时间变化的曲线如图所示。下列叙述中正确的是( )
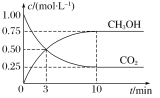
A.升高温度能使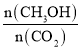 增大
增大
B.反应达到化学平衡时,![]() 的转化率为75%
的转化率为75%
C.![]() 时,用
时,用![]() 表示的正反应的反应速率等于用
表示的正反应的反应速率等于用![]() 表示的逆反应的反应速率
表示的逆反应的反应速率
D.从反应开始到反应达到平衡状态,![]() 的平均反应速率
的平均反应速率![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是
A.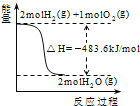 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241kJ/mol
表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241kJ/mol
B.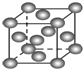 表示Cu形成金属晶体时的堆积方式
表示Cu形成金属晶体时的堆积方式
C.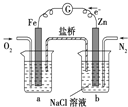 装置中烧杯a中的溶液pH降低
装置中烧杯a中的溶液pH降低
D.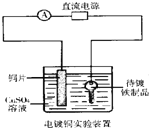 装置中待镀铁制品应与电源正极相连
装置中待镀铁制品应与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,写出298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)热化学方程式:__________________________________________。
(2)在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
①随着温度的升高,该反应的化学平衡常数减小,则ΔH___(填“>”“<”或“=”)0,反应从起始到30min内A的平均反应速率是_______,该温度下,上述反应的化学平衡常数为____。
②下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A. 反应速率:vA(正) =vC(逆) B. A的质量和C的质量相等
C. B的转化率不再改变 D. 密度不再改变
(3)若反应C(g)A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与压强、X的物质的量的关系如图所示。
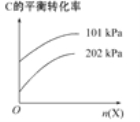
当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:


(1)甲烷燃料电池负极反应式是__________________;
(2)石墨(C)极的电极反应式为________________________;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L ,丙装置中阴极析出铜的质量为________g;
(4)某同学利用甲烷燃料电池设计电解法制取Fe(OH)2的实验装置(如图所示),用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com