
| A. | 将混合气体通过氢氧化钠溶液 | |
| B. | 使混合气体中的乙烯发生加聚反应 | |
| C. | 将混合气体在催化剂条件下跟氢气反应 | |
| D. | 将混合气体通过溴水 |
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中含有阴离子的数目为2NA | |
| B. | 3.6g水含有极性键的数目为0.4NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“APEC蓝” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
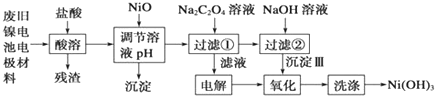
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
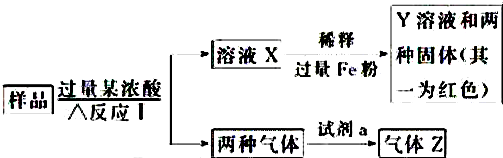
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
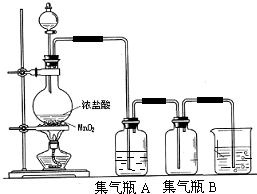 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com