
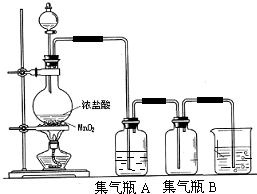
 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取:分析 实验室用加热浓盐酸与二氧化锰方法制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢,通过盛有饱和食盐水的洗气瓶分别除去氯化氢,氯气密度大于空气密度,应选择向上排空气法收集,氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气.
(1)该反应中Cl元素化合价由-1价变为0价、Mn元素化合价由+4价变为+2价,失电子的物质是还原剂;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质;
(3)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气;
(4)新制氯水中存在Cl2+H2O?H++Cl-+HClO,所含分子只有Cl2和H2O、HClO分子,所含的离子只有H+、Cl-、ClO-和OH-,结合对应微粒的性质解答该题.
解答 解:实验室用加热浓盐酸与二氧化锰方法制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢,通过盛有饱和食盐水的洗气瓶分别除去氯化氢,氯气密度大于空气密度,应选择向上排空气法收集,氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气.
(1)由方程式可知,反应中-1价氯元素化合价升高为氯气中0价,二氧化锰中+4价锰元素化合价降低为+2价,存在化合价升降为氧化还原反应,氯化氢为还原剂,二氧化锰为氧化剂,反应实质:酸性环境下二氧化锰氧化氯离子生成氯气,本身被还原为二价锰离子,离子方程式为4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O,
故答案为:MnO2;HCl;4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,结合氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大,所以可以用盛有饱和食盐水的洗气瓶除去氯气中的氯化氢;
故答案为:吸收挥发出来的HCl;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:NaOH;2NaOH+Cl2=NaCl+NaClO+H2O;
(4)将足量氯气溶于水制成的饱和氯水呈浅黄绿色,反应的化学方程式为Cl2+H2O?HCl+HClO,由于其见光易分解,因此需保存在棕色瓶中,氯水含有盐酸和次氯酸,溶液呈酸性,存在大量的H+,则pH<7,向pH试纸上滴加新制氯水,溶液呈酸性,则先变红,但由于次氯酸具有漂白性,则最终试纸褪色,向氯水中滴加经稀硝酸酸化的硝酸银溶液,由于溶液中含有Cl-,则生成AgCl沉淀,
故答案为:浅黄绿;Cl2+H2O?HCl+HClO;棕色;酸性和漂白性(或酸性和氧化性);生成白色沉淀;Cl-.
点评 本题以氯气的实验室制法来考查物质的性质以及制备实验的设计与评价,为高考常见题型,侧重于学生的分析、实验能力的考查,明确实验原理、装置的作用、利用元素的化合价分析氧化还原反应是解答本题的关键,难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,60gCH3COOH中含共用电子对数为7NA | |
| B. | 56g聚乙烯含有的碳原子数为4NA | |
| C. | 2molSO2和1molO2在密闭容器中充分反应后,容器内物质分子数等于2NA | |
| D. | 2L0.5mol/L乙酸溶液中H原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将混合气体通过氢氧化钠溶液 | |
| B. | 使混合气体中的乙烯发生加聚反应 | |
| C. | 将混合气体在催化剂条件下跟氢气反应 | |
| D. | 将混合气体通过溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2都属于氧化物 | B. | H2SO4、CH3COOH都属于酸 | ||
| C. | 烧碱、纯碱都属于碱 | D. | Na2CO3、NaHCO3都属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
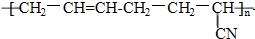 具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )| A. | 1种 加聚反应 | B. | 2种 缩聚反应 | C. | 2种 加聚反应 | D. | 3种 缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
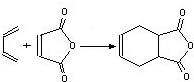
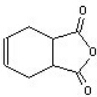 互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种.
互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种. ,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):
,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):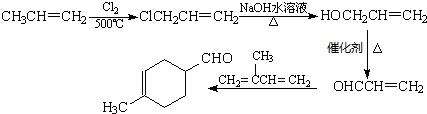 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com