
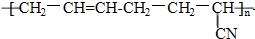 具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )| A. | 1种 加聚反应 | B. | 2种 缩聚反应 | C. | 2种 加聚反应 | D. | 3种 缩聚反应 |
分析 丁腈橡胶为加聚反应产物,加聚产物的单体推断方法为:
(1)凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;
(2)凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可;
(3)凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换.
解答 解:该高聚物链节主链不含杂原子,属于加聚反应生成的高聚物,链节主链上存在碳碳双键结构,有6个碳原子,其单体必为两种,按如图所示断开 ,在将双键中的1个C-C打开,然后将半键闭合即可的该高聚物单体为:CH2=CH-CH=CH2、CH2=CH-CN,所以其单体有两种,该反应属于加聚反应,故选C.
,在将双键中的1个C-C打开,然后将半键闭合即可的该高聚物单体为:CH2=CH-CH=CH2、CH2=CH-CN,所以其单体有两种,该反应属于加聚反应,故选C.
点评 本题考查有机物结构和性质,为高频考点,明确加聚反应断键和成键方式是解本题关键,知道由高分子化合物判断其合成单体的方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
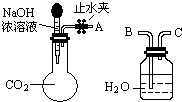 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
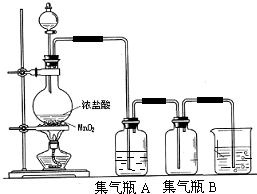 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C3H8O | C. | C2H4O2 | D. | CH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁的吸氧腐蚀和析氢腐蚀的正极反应式均为:Fe-2e-═Fe2+ | |
| B. | 钢铁发生吸氧腐蚀时,负极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 地下钢管连接镁块防腐的方法为“牺牲阳极的阴极保护法” | |
| D. | 钢铁发生吸氧腐蚀时,钢铁制品的质量一定减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 分子中三个碳原子以单键结合成链状 | |
| C. | C3F8与C3H8互为同分异构体 | |
| D. | 全氟丙烷的电子式为 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com