
【题目】(1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:

①该反应的ΔH_______0(填 “大于”“小于”或“等于”);
②反应物的总键能为______________;
③写出该反应的热化学方程式________________________________。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
写出联氨的结构式_______________,上述反应热效应之间的关系式为ΔH4=__________,联氨和N2O4可作为火箭推进剂的主要原因为_______________________________。
【答案】N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1大于akJ·mol-1A2(g)+B2(g)===2AB(g) ΔH=+(a-b)kJ·mol-1![]() 2ΔH3-2ΔH2-ΔH1反应放热量大、产生大量气体、无污染
2ΔH3-2ΔH2-ΔH1反应放热量大、产生大量气体、无污染
【解析】
(1)根据“ΔH=反应物的键能总和-生成物的键能总和”计算。
(2)根据“反应物的总能量小于生成物的总能量”判断反应为吸热反应。结合图像书写热化学方程式。
(3)根据价键规则书写N2H4的结构式;根据盖斯定律分析反应热之间的关系。
(1)N2与H2反应生成NH3的化学方程式为N2(g)+3H2(g)=2NH3(g),该反应的ΔH=反应物的键能总和-生成物的键能总和=E(N≡N)+3E(H—H)-6E(N—H)=946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol;N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol。
(2)①1molA2(g)和1molB2(g)具有的总能量小于2molAB(g)具有的总能量,反应A2(g)+B2(g)=2AB(g)为吸热反应,ΔH大于0。
②根据图像,反应物的总键能为akJ/mol。
③根据图像,该反应的ΔH=+(a-b)kJ/mol,该反应的热化学方程式为:A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ/mol。
(3)N原子最外层有5个电子,H原子最外层有1个电子,根据价键规则,N2H4的电子式为![]() ,N2H4的结构式为
,N2H4的结构式为![]() 。应用盖斯定律,消去O2(g)、H2(g),将③×2-①-②×2得④,则ΔH4=2ΔH3-ΔH1-2ΔH2。根据反应④知,联氨和N2O4可作为火箭推进剂的主要原因为:反应放热量大、产生大量气体、无污染。
。应用盖斯定律,消去O2(g)、H2(g),将③×2-①-②×2得④,则ΔH4=2ΔH3-ΔH1-2ΔH2。根据反应④知,联氨和N2O4可作为火箭推进剂的主要原因为:反应放热量大、产生大量气体、无污染。


科目:高中化学 来源: 题型:
【题目】在空气中的自由离子附着在分子或原子上形成的空气负离子被称为“空气维生素”。O22—就是一种空气负离子,则O22—的摩尔质量为
A. 32g B. 34g C. 32g/mol D. 34g·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下33.6L氯气与27g铝充分反应,转移的电子数为3NA
B. 标准状况下,28g乙烯和丙烯的混合气体中所含原子个数为4NA
C. 一定条件下,将1molN2与3molH2混合反应后,生成NH3分子的数目为2NA
D. 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1L,在阳极析出的气体分子数约为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中数据,推测磷元素的原子半径可能是( )
元素 | N | S | O | Si |
原子半径/(10-10m) | 0.75 | 1.02 | 0.73 | 1.11 |
A.0.80×10-10mB.1.10×10-10m
C.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol L-1。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为( )(反应前后溶液体积变化忽略不计)
A. 0.225 mol L-1 B. 0.30 mol L-1 C. 0.36 mol L-1 D. 0.45 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,
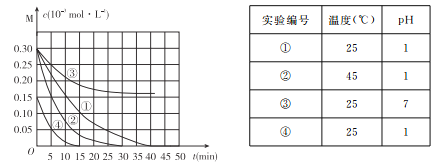
下列说法不正确的是
A. 实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越不利于M的降解
D. 实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蒸馏时,应使温度计水银球插入液面下
B. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C. 酸、碱和盐类都属于电解质,其他化合物都是非电解质
D. 纯水的导电性很差,所以水不是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com