
【题目】在空气中的自由离子附着在分子或原子上形成的空气负离子被称为“空气维生素”。O22—就是一种空气负离子,则O22—的摩尔质量为
A. 32g B. 34g C. 32g/mol D. 34g·mol—1
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C (g),各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
2C (g),各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

下列说法正确的是
A. 10min内甲容器中反应的平均速率v(A)=0.025mol/(Lmin)
B. 由图可知:T1<T2,且该反应为吸热反应
C. x=1,若平衡时保持温度不变,改变容器体积平衡移动
D. T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境.
(1)用足量氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2和(NH4)2SO4两种产品.相关反应的化学方程式为________、________.
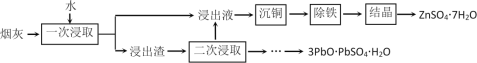
(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等.烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是________.
② “一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以________(填化学式)残留在浸出渣中,“二次浸取”应选择_________(填化学式)作浸取剂.
(3)从贵金属阳极泥中可提取粗银.电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为________.阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容密闭容器中,加入3mol A和1mol B,一定条件下发生反应3A(g)+B(g)![]() 2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持容器的容积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持容器的容积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
A. 6mol A+2mol B
B. 2mol C+2mol D
C. 1.5mol A+0.5mol B+1mol C+0.5mol D
D. 3mol A+1mol B+2mol C+2mol D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 molX和3molY在容器中发生2X(?)+3Y(气)![]() 3Z(?)反应已达平衡状态,若增加压强或降低温度,Y的体积分数都减小,则下列说法正确的是( )
3Z(?)反应已达平衡状态,若增加压强或降低温度,Y的体积分数都减小,则下列说法正确的是( )
A. 可能X、Z均是气体,也可能X、Z都不是气体。正反应放热
B. 可能X是气体,Z不是气体,正反应放热
C. 可能X是气体,Z是气体,正反应吸热
D. X、Z一定都是气体,正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,反应ClF(g)+F2(g) ![]() ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是( )
ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是( )
A. 温度不变,缩小体积,ClF的转化率增大
B. 温度不变,增大体积,ClF3的产率提高
C. 升高温度,增大体积,有利于平衡向正反应方向移动
D. 降低温度,体积不变,F2的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
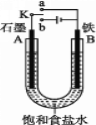
(1)若开始时开关K与a连接,则B极的电极反应式________。向B极附近滴加铁氰化钾溶液现象是_____________发生反应的离子方程式___________
(2)若开始时开关K与b连接,则B极的电极反应为_____________________,总反应的离子方程式为_____________。习惯上把该工业生产称为________
(3)有关上述实验,下列说法正确的是_______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应很短一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
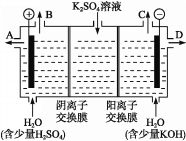
①该电解槽的阳极反应为_______________。 此时通过阴离子交换膜的离子数______(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:

①该反应的ΔH_______0(填 “大于”“小于”或“等于”);
②反应物的总键能为______________;
③写出该反应的热化学方程式________________________________。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
写出联氨的结构式_______________,上述反应热效应之间的关系式为ΔH4=__________,联氨和N2O4可作为火箭推进剂的主要原因为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com