
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
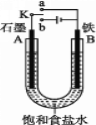
(1)若开始时开关K与a连接,则B极的电极反应式________。向B极附近滴加铁氰化钾溶液现象是_____________发生反应的离子方程式___________
(2)若开始时开关K与b连接,则B极的电极反应为_____________________,总反应的离子方程式为_____________。习惯上把该工业生产称为________
(3)有关上述实验,下列说法正确的是_______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应很短一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
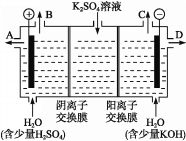
①该电解槽的阳极反应为_______________。 此时通过阴离子交换膜的离子数______(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_______________________________。
【答案】Fe-2e- = Fe2+ 出现带有特征蓝色的沉淀 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2 2H++2e- = H2↑ 2Cl-+2H2O ![]() 2OH-+ H2↑+ Cl2↑ 氯碱工业 B 2H2O-4e- = 4H+ + O2↑ 小于 D H2O
2OH-+ H2↑+ Cl2↑ 氯碱工业 B 2H2O-4e- = 4H+ + O2↑ 小于 D H2O![]() H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+)
H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+)
【解析】
(1)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成Fe2+,Fe2+遇到铁氰化钾溶液出现带有特征蓝色的沉淀;
(2)开关K与b连接,装置为电解池,铁与电池的负极相连,为阴极,不参与电解反应,氢离子得到电子发生还原反应,生成氢气;
(3)利用电解原理分析;
(4) 电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾,则用惰性电极电解,溶液中的OH-在阳极失电子产生O2:4OH--4e-=2H2O+O2↑,所以在B口放出O2,从A口导出H2SO4。因SO42-所带电荷数大于K+所带电荷数,SO42-通过阴离子交换膜,K+通过阳离子交换膜,所以通过阳离子交换膜的离子数大于通过阴离子交换膜的离子数。
(1)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成Fe2+,Fe2+遇到铁氰化钾溶液出现带有特征蓝色的沉淀,故答案为:Fe-2e-=Fe2+;出现带有特征蓝色的沉淀;3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2 ;
(2)开关K与b连接,装置为电解池,铁与电池的负极相连,为阴极,铁不参与电解反应,氢离子得到电子发生还原反应,生成氢气,电极反应式:2H++2e- = H2↑;电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为:2Cl-+2H2O ![]() 2OH-+ H2↑+ Cl2↑;电解过程中生成碱和氯气,又称氯碱工业;答案为:2H++2e- = H2↑;2Cl-+2H2O
2OH-+ H2↑+ Cl2↑;电解过程中生成碱和氯气,又称氯碱工业;答案为:2H++2e- = H2↑;2Cl-+2H2O ![]() 2OH-+ H2↑+ Cl2↑;氯碱工业;
2OH-+ H2↑+ Cl2↑;氯碱工业;
(3)电解氯化钠溶液时,电极不参与反应,A为阳极,B为阴极。
A.溶液中的阳离子向阴极移动,阴离子向阳极移动,溶液中Na+向B极移动,A错误;
B.阳极氯离子失电子生成氯气,与碘离子反应生成单质碘,淀粉显蓝色,B正确;
C.电解很短时间,出来的气体为氢气、氯气,加入氯化氢可还原,C错误;
D. B极产生标准状况下2.24L氢气,2H++2e-=H2↑,由于溶液中无法转移电子,D错误;答案为B
(4) ①电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾,则用惰性电极电解,溶液中的OH-在阳极失电子产生O2:4OH--4e-=2H2O+O2↑,所以在B口放出O2,从A口导出H2SO4。因SO42-所带电荷数大于K+所带电荷数,SO42-通过阴离子交换膜,K+通过阳离子交换膜,所以通过阳离子交换膜的离子数大于通过阴离子交换膜的离子数。答案为:2H2O-4e- = 4H+ + O2↑;小于;
②溶液中的H+在阴极得到电子产生H2:2H++2e-=H2↑,则从C口放出H2,从D口导出KOH溶液。答案为:D;
③H2O![]() H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+);答案为: H2O
H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+);答案为: H2O![]() H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+);
H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+);


科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
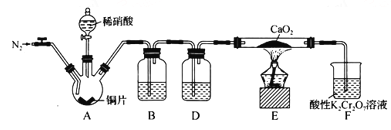
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中的自由离子附着在分子或原子上形成的空气负离子被称为“空气维生素”。O22—就是一种空气负离子,则O22—的摩尔质量为
A. 32g B. 34g C. 32g/mol D. 34g·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1 molCH4转移12 mol电子
3H2+CO,每消耗1 molCH4转移12 mol电子
B. 电极B上发生的电极反应:O2+2CO2+4e-=2CO32-
C. 电池工作时,CO32-向电极B移动
D. 电极A上H2参与的电极反应:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:________________;(填编号)
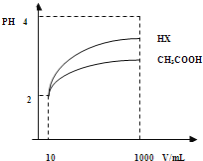
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_________________,稀释后,HX溶液中水电离出来的c(H+)_______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=____________________.(填准确数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下33.6L氯气与27g铝充分反应,转移的电子数为3NA
B. 标准状况下,28g乙烯和丙烯的混合气体中所含原子个数为4NA
C. 一定条件下,将1molN2与3molH2混合反应后,生成NH3分子的数目为2NA
D. 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1L,在阳极析出的气体分子数约为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,
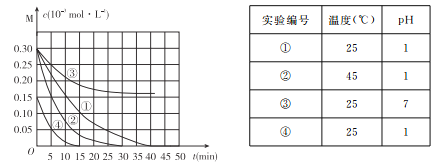
下列说法不正确的是
A. 实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越不利于M的降解
D. 实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com