
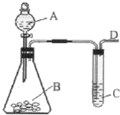
 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.分析 (1)亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水;
(2)①二氧化硫为酸性氧化物与水反应生成亚硫酸;
②依据二氧化硫的还原性解答;
③二氧化硫与氢氧化钙反应生成亚硫酸钙沉淀;
④依据二氧化硫具有漂白性结合碳酸盐与盐酸反应生成二氧化碳解答.
解答 解:(1)亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水,化学方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)①二氧化硫为酸性氧化物与水反应生成亚硫酸,亚硫酸电离产生氢离子,溶液显酸性,少量SO2通入紫色石蕊试液溶液变红,二氧化硫不能漂白石蕊试液,所以红色不退去;
故答案为:溶液变红;红色不褪去;
②二氧化硫具有强的还原性,能够还原酸性的高锰酸钾,使其褪色,
故答案为:褪色;
③二氧化硫与氢氧化钙反应生成亚硫酸钙沉淀,所以看到现象为:溶液变浑浊;
故答案为:变浑浊;
④二氧化硫具有漂白性,能够使品红溶液褪色;制备二氧化硫用的亚硫酸钠中若含有碳酸钠等,碳酸盐能够与盐酸反应生成二氧化碳,
故答案为:品红褪色;碳酸盐.
点评 本题考查了元素化合物知识,明确二氧化硫的漂白性、酸性氧化物性质、还原性是解题关键,注意二氧化硫漂白的原理,题目难度不大.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+ Ba2+ Cl- SO42- | B. | K+ Na+ NO3- OH- | ||
| C. | H+ NH4+ Fe3+ SO42- | D. | H+ Cl- CO32- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯 | |
| B. | 分子式为C4H8Cl2结构中含一个-CH3的同分异构体(不考虑立体异构)有5种 | |
| C. | 1mol乙酰水杨酸( )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 可用 和HCHO为原料合成 和HCHO为原料合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Mg2+的数目减少 | B. | Mg2+的浓度增大 | ||
| C. | 溶液pH不变 | D. | Mg(OH)2固体质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| C. | 燃料电池反应时,化学能升高 | |
| D. | 反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl易溶于水 | B. | 熔融的NaCl能导电 | ||
| C. | NaCl不易分解 | D. | NaCl溶于水呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )| A. | ①③ | B. | ①②③ | C. | ②④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com